В реакциях присоединения к алкенам переходное состояние ближе по энергии к промежуточному продукту (карбокатиону) и, следовательно, структурные факторы, стабилизирующие (понижающие энергию) промежуточный продукт, будут стабилизировать и активированный комплекс.
Рассмотрим, как строение карбониевых катионов влияет на их устойчивость. В зависимости от строения вступающего в реакцию присоединения алкена могут образовываться первичные, вторичные и третичные карбокатионы.
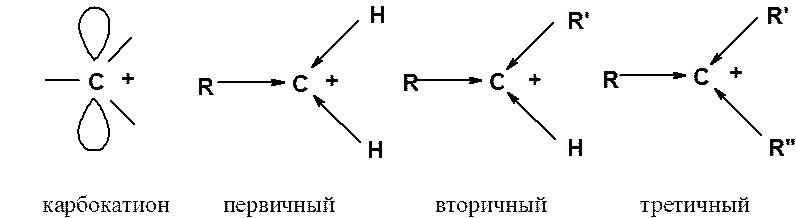
В карбокатионе положительно заряженный атом углерода находится в sp2-гибридном состоянии. Алкильные группы обладают большим положительным индуктивным эффектом по сравнению с атомом водорода. Донорный эффект заместителей, связанных с положительно заряженным углеродом, приводит к увеличению электронной плотности на карбокатионном центре и понижению его энергии. Увеличение числа алкильных групп у карбокатионного центра повышает его стабильность. Устойчивость карбокатионов растет в ряду метильный < первичный < вторичный < третичный.
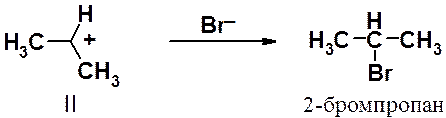
Образование вторичного карбокатиона II происходит с меньшей энергией активации и большей скоростью, чем первичного карбокатиона I. Это объясняет тот факт, что именно карбокатион II является интермедиатом в рассматриваемой реакции.
Вторая стадия реакции – взаимодействие карбокатиона II с анионом брома – протекает очень быстро и приводит к образованию 2-бромпропана.
Общее правило: электрофильное присоединение к двойной углерод-углеродной связи протекает через образование наиболее стабильного карбокатиона.
«Правило Марковникова» совпадает с современным объяснением региоселективности присоединения несимметричных реагентов к несимметричным алкенам. Но Марковников сформулировал свое правило для объяснения протекания реакций присоединения галогеноводородных кислот исключительно к этиленовым углеводородам. Наличие в молекуле алкена акцепторных группировок приводит к протеканию реакции против правила Марковникова (в редакции автора), но в соответствии с современной трактовкой.
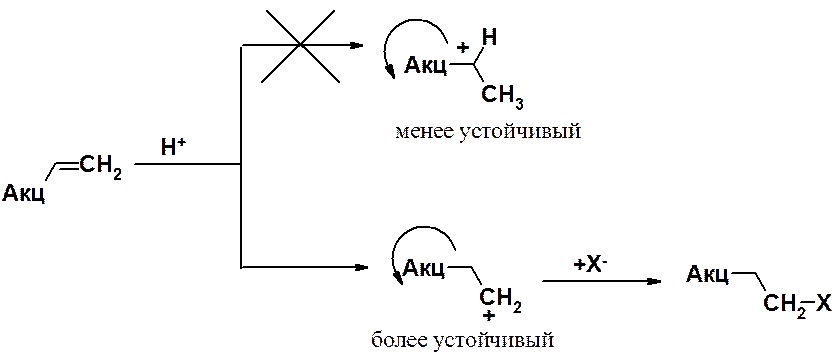
В этом примере вторичный карбокатион менее устойчив, чем первичный, т.к. акцепторная группировка находится рядом с заряженным атомом углерода и дополнительно понижает на нем электронную плотность. В случае первичного карбокатиона акцепторная группа и заряженный атом углерода разделены двумя простыми связями. Поскольку индуктивный эффект проявляется на близких расстояниях, первичный карбокатион будет более стабилен.
Поэтому и в рассматриваемом случае присоединение НХ будет протекать через образование наиболее стабильного – первичного - карбокатиона.
· Алкены. Реакции радикального присоединения - реакции против «правила Марковникова». Каталитическое гидрирование алкенов. Окисление: реакция гидроксилирования, образование оксиранов, озонолиз, окислительное расщепление двойной связи.
Присоединение HCl и HI к алкенам всегда протекает в соответствии с правилом Марковникова (в современном понимании). Присоединение же бромистого водорода может протекать как по Марковникову, так и против этого правила. Объяснение этому факту дали в 1933 г. М. Хараш и Ф. Майо, которые установили, что направление присоединения зависит от механизма реакции. В условиях электрофильного присоединения реакция всегда протекает через образование наиболее устойчивого карбокатиона (в соответствии с правилом Марковникова). Наличие в реакционной смеси пероксидов или веществ, способных в условиях превращения генерировать свободные радикалы, приводит к изменению механизма реакции и она проходит как цепное радикальное присоединение (АR). В качестве инициаторов чаще всего используют органические перекиси.
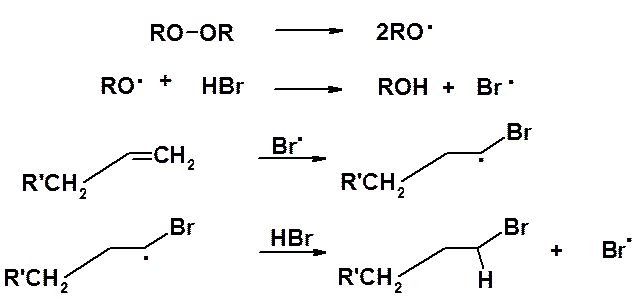
Пероксидная связь подвергается гомолитическому расщеплению при незначительном нагревании в темноте или при комнатной температуре на свету. Взаимодействие свободных радикалов с бромистым водородом приводит к образованию свободных атомов брома, атакующих алкен с образованием алкильного радикала, который в свою очередь реагирует с молекулой бромистого водорода, образуя галогенопроизводное и свободный атом брома, ведущий цепь дальше. Промежуточная частица в этой реакции свободный алкильный радикал. Реакция будет протекать через образование наиболее стабильного алкильного радикала. Как было показано ранее (см. раздел алканы), устойчивость алкильных радикалов растет в ряду метильный < первичный < вторичный < третичный.
Учитывая изменение механизма присоединения бромоводорода к алкенам в присутствии перекисей не вызывает удивления изменение региоориентации в рассматриваемой реакции.
Присоединение воды к алкенам происходит в присутствии разбавленных минеральных кислот (H2SO4, H3PO4) или действием Al2O3 при 400о, приводя к спиртам.
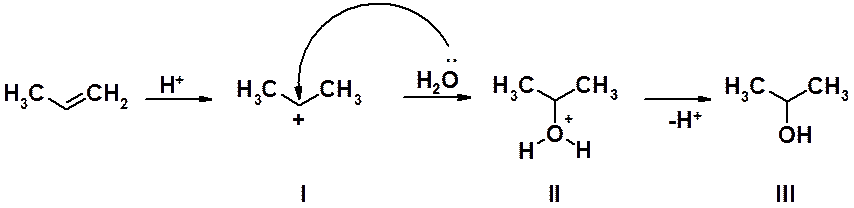
На первой стадии происходит атака электрофильной частицей (протоном минеральной кислоты) электронов p-связи, приводящая к образованию s-комплекса I. Это медленная стадия реакции, определяющая ход процесса в целом. Карбокатион I взаимодействует с нуклеофильной частицей, в роли которой выступает молекула воды, предоставляющая одну из своих электронных пар для образования С-О связи. На заключительной стадии оксониевый катион II теряет протон, образуя спирт III.
Как было показано выше, региоориентация присоединения определяется стабильностью промежуточно образующегося карбокатиона и не зависит от природы нуклеофильной частицы. Поэтому гидратация несимметричных алкенов всегда приводит к получению вторичных или третичных спиртов. Единственным исключением является присоединение воды к этилену, в результате которого образуется первичный спирт этанол.
Галогенгидринами называют соединения, содержащие вицинально расположенные гидроксильную группу и атом галогена. Их получают реакцией алкенов с водными растворами хлора или брома.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.