Изменение энтальпии DH, по существу, - разность энергий связей реагентов и продуктов, включая энергии сопряжения, напряжения и сольватации. DH можно рассчитать, суммируя энергии всех разрывающихся в ходе реакции связей и вычитая из них сумму энергий всех образующихся связей, прибавив все изменения энергий сопряжения, напряжения и сольватации. Кроме того, изменение энтальпии можно определить экспериментально, измерив тепловой эффект реакции, т.к. изменение энтальпии равно тепловому эффекту реакции, взятому с обратным знаком.
- DH = Qр
Изменение энтропии DS характеризует меру беспорядка системы. В органической химии этот фактор редко играет большую роль, т.к. реакции идут при относительно небольших температурах, при которых энтропийный фактор мал. Тем не менее, в некоторых случаях изменение энтропии может играть заметную роль:
· поскольку газы имеют более высокую энтропию, чем жидкости (тем более, чем твердые вещества), то любая реакция, в которой исходные вещества жидкие или твердые, а один или более продуктов – газообразные, термодинамически выгодна, поскольку энтропия системы возрастает;
· если в ходе реакции образуется больше молекул продуктов, чем молекул исходных веществ, то реакция протекает с увеличением энтропии.
Само по себе отрицательное значение DG не означает, что реакция будет протекать в обозримый период времени. Отрицательная величина изменения свободной энергии является необходимым, но не достаточным фактором самопроизвольного протекания химической реакции. Например, реакция двух моль водорода с одним моль кислорода, протекающая с образованием воды, характеризуется большой отрицательной величиной изменения свободной энергии. Однако, смесь О2 и Н2 может десятилетиями храниться при комнатной температуре без каких-либо признаков химической реакции.
Для понимания органических реакций чрезвычайно полезно знание их механизмов.
Механизм реакции – детальное описание процесса превращения исходных соединений в продукты. Механизм включает данные о способе и последовательности разрыва и образования связей, строении интермедиатов (промежуточных продуктов), кинетике, термодинамике и стереохимии реакции. Механизм не должен противоречить имеющимся экспериментальным фактам, а при появлении новых объяснять и их.
При рассмотрении тонких особенностей механизмов чрезвычайно полезно использование так называемой энергетической диаграммы (энергетического профиля) реакции. Это графическая зависимость энергии системы от сложной функции расстояния между реагирующими веществами, которую обычно называют «координатой реакции» или «ходом реакции» (рис 3.1).
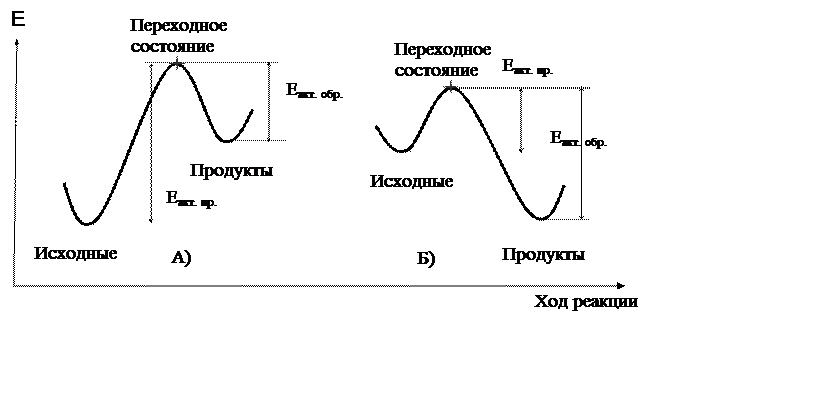 |
Рис. 3.1. Энергетическая диаграмма: А – эндо-, Б – экзотермическая реакция.
Данный рисунок иллюстрирует протекание одностадийных реакций. Эндотермическая реакция проходит с поглощением тепла, экзотермическая – с выделением.
Практически все химические реакции происходят при столкновении двух или более, что очень редко, реагирующих частиц. Из рис. 3.1 видно, что сближение реагирующих молекул ведет к возрастанию энергии системы до некоторого максимума. Соударения будут эффективными в том случае, когда реагирующие вещества обладают некоторым избытком энергии по сравнению со средней энергией молекул в системе. Не имеющие такого избытка энергии частицы после соударения разлетаются в разные стороны. Энергия активации - избыток энергии, необходимый для преодоления энергетического барьера. Максимальной энергии системы (высшая точка энергетической диаграммы) соответствует переходное состояние (активированный комплекс). Именно наличие переходного состояния объясняет причину того, что даже экзотермические реакции обычно не происходят самопроизвольно, а только при нагревании или других способах активации системы.
Именно переходное состояние – высшая энергетическая точка реакции – определяет ход всего превращения. Знание его строения способно внести ясность в механизм химического превращения. Однако, время жизни активированного комплекса столь мало, что не существует физических методов, позволяющих его зарегистрировать, и, следовательно, получить знания о его строении.
Для косвенной оценки строения переходного состояния используют постулат Дж. Хэммонда (1955 г.): несущественные энергетические изменения сопровождаются незначительными изменениями молекулярной структуры. Более понятная формулировка: строение переходного состояния похоже на строение тех веществ, к которым оно ближе по энергии. В экзотермических реакциях переходное состояние ближе по строению к исходным реагентам (рис. 3.1). Такой активированный комплекс называют ранним переходным состоянием. Переходное состояние в эндотермических реакциях ближе по структуре к продуктам реакции, его называют поздним. Однотипные воздействия на похожие структуры приводят к близкому результату. Поэтому все факторы, стабилизирующие (понижающие энергию состояния) энергетически близкое к переходному состоянию исходное, промежуточное или конечное вещество, понижают и энергию активированного комплекса.
Использование постулата Хэммонда особенно полезно при рассмотрении многостадийных реакций (рис. 3.2).
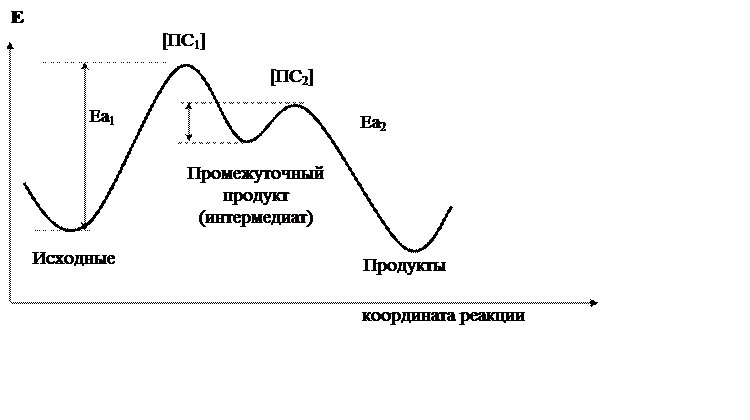 |
Рис 3.2. Энергетическая диаграмма двухстадийной реакции
Из рисунка 3.2 видно, что реакция протекает в две стадии, через один промежуточный продукт. Превращение продуктов в интермедиат (первая стадия) имеет большее значение для всей реакции, чем превращение интермедиата в продукты реакции (вторая стадия). В этом убеждают соответствующие энергии активации первой и второй стадий (Ea1 и Ea2 соответственно). Весь ход реакции определяет её высшая энергетическая точка - переходное состояние первой стадии [ПС1]. Если применить к этой реакции постулат Хэммонда, легко сделать вывод, что к переходным состояниям обеих стадий реакции энергетически ближе всего промежуточный продукт.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.