Относительные скорости бромирования по третичному, вторичному и первичному атомам углерода относятся как 1600 : 82 : 1. В реакции хлорирования та же закономерность. Однако хлор значительно более реакционноспособный, следовательно, менее избирательный (селективный) реагент, поэтому разница в скоростях не столь значительна и составляет 5,0 : 3,8 : 1,0 соответственно. Поэтому реакция хлорирования всегда приводит к сложным смесям продуктов монохлорирования. Поэтому, если в ходе решения задачи нужно получить моногалогенопроизводное прямым галогенированием алкана, следует проводить реакцию бромирования.
Как уже было отмечено выше, реакционная способность алканов низка. Наряду с хлорированием и бромированием можно отметить еще лишь несколько реакций. В 1888 г. М.И. Коновалов описал реакцию жидкофазного нитрования алканов. Реакция Коновалова протекает при 100-150оС под действием 10-15 % азотной кислоты.
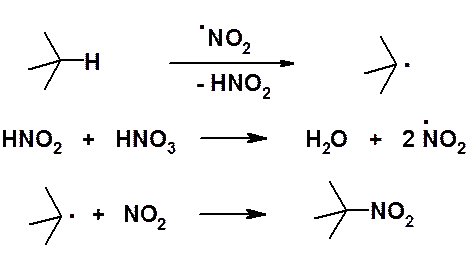
Жидкофазное нитрование протекает с низким выходом и в 1934 г. было модифицировано Г.Б. Хаасом, который предложил проводить нитрование в паровой фазе (реакция Коновалова-Хааса).
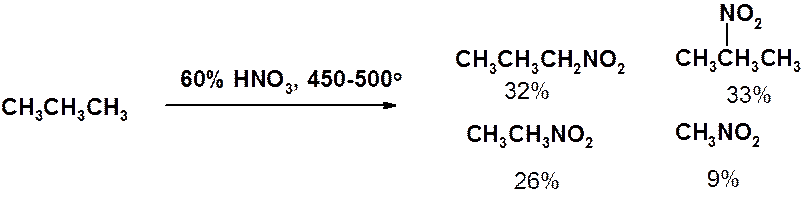
Реакция протекает по радикальному механизму. Хотя легкость замещения водорода при нитровании изменяется в обычной последовательности третичный > вторичный > первичный > метильный, реакция сопровождается деструкцией с образованием всех возможных мононитропроизводных.
Среди функционализированных алканов важное место занимают сульфопроизводные (СМС). Концентрированная серная кислота действует на низшие алканы как окислитель и прямое сульфирование возможно лишь в случае высших производных. Для введения в молекулу предельного углеводорода сульфогруппы обычно используют обходной путь, применяя реакцию сульфохлорирования (действие SO2+Cl2) или сульфоокисление (SO2+O2).
При освещении ультрафиолетовым светом парафины вступают в реакцию замещения со смесью хлора и оксида серы (IV) с образованием сульфохлоридов.
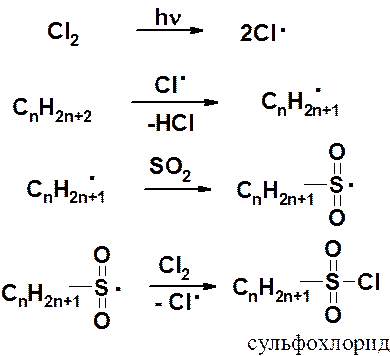
Реакция протекает по цепному механизму. Стадия инициирования – гомолитическое расщеплении молекулы хлора.
Одним из наиболее важных направлений использования алканов является применение их в качестве топлива. Пламенное окисление алканов в присутствии кислорода воздуха приводит к их полному сгоранию до углекислого газа и воды с выделением большого количества тепла.
![]()
Механизм этой реакции до конца не установлен, несмотря на наличие большого числа математических моделей. Нет сомнений, что это свободнорадикальная цепная реакция.
При сжатии смеси паров бензина, состоящего из алканов, с воздухом образуются перекисные соединения, вызывающие так называемую «детонацию». Легче всего образуют перекиси алканы нормального строения, из которых состоит так называемый «бензин прямой гонки». Значительно лучшие антидетонационные свойства имеют алканы, в структуре которых есть четвертичный атом углерода. В основу условной шкалы оценки моторных топлив был положен изооктан (2,2,3-триметилпентан), которому было приписано октановое число 100, а н-гептану, обладающему сильными детонационными свойствами, - 0. Следует отметить, что имеются топлива, имеющие октановое число и больше 100. Бензин марки АИ-95 имеет точно такие же антидетонационные свойства, как смесь 95% изооктана и 5% н-гептана.
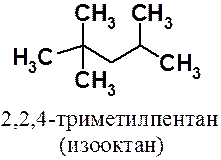
Химической промышленности необходимо большее количество низших углеводородов, чем может быть извлечено из углеводородного сырья. Алканы подвергаю пиролизу (от греческих слов pyr – огонь и lisis – разрушение), т.е. термическому разложению. Пиролиз алканов называют крекингом. Термический крекинг состоит в пропускании алканов через металлическую колонку, нагретую до высокой температуры (от 450 до 900оС). При этом высшие алканы превращаются в насыщенные соединения с меньшим молекулярным весом, алкены и водород. В качестве примера приведем крекинг пропана, приводящий к образованию пропилена, этилена, метана и водорода.
![]()
· Основные методы получения алканов: гидрирование алкенов и алкинов, восстановление кислород- и галогенсодержащих соединений, реакция Вюрца, декарбоксилирование и электролиз солей карбоновых кислот. Природные источники алканов.
Основные природные источники предельных углеводородов - нефтяные и газовые месторождения. Природный газ содержит в основном низшие алканы, находящиеся при н.у. в газообразном состоянии (метан, этан, пропан и бутан).
Сырая нефть состоит из сотен химических соединений. Для получения веществ, которые можно использовать в качестве горючего и сырья для химической промышленности, сырую нефть подвергаю фракционной перегонке. Получаемые фракции представляют собой смеси органических соединений различных классов, кипящих в соответствующем интервале температур.
Фракционный состав нефти
|
Фракция |
Т. кип. (оС) |
Число атомов углерода |
Применение |
|
Газ |
< 20 |
C1 – C4 |
Топливо |
|
Петролейный эфир |
20 – 100 |
С5 – С7 |
Растворитель |
|
Природный бензин |
40 – 205 |
С5 – С10 и циклоалканы |
Двигатели внутреннего сгорания |
|
Керосин |
175 – 325 |
С12 – С18 и ароматические углеводороды |
Реактивные двигатели |
|
Газойль (соляровое масло) |
200 – 400 |
С12 и выше |
Дизельные двигатели |
|
Смазочные масла |
Нелетучие жидкие |
Высшие алканы, содержащие циклические фрагменты |
Смазочные масла |
|
Асфальт (битум) |
Нелетучие твердые |
Полициклические |
Покрытие дорог |
Выделяемые из нефтяных фракций индивидуальные химические соединения являются ценнейшим сырьем для получения массы необходимых продуктов (лекарства, полимеры и т.д.).
Все методы получения органических соединений могут быть разделены на две большие группы: промышленные и лабораторные.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.