Характерной особенностью алкенов, определяющей их химические свойства, является наличие двойной углерод-углеродной связи, которая является комбинацией p- и s-связей. Энергия p-связи (60 ккал/моль) меньше, чем s-связи (85 ккал/моль). Типичными для двойной связи являются реакции присоединения, при которых происходит разрыв p-связи с образованием двух s-связей:
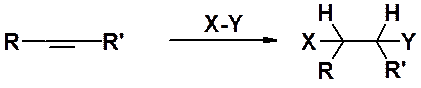
При этом из двух или большего числа простых молекул образуется одно более сложное соединение.
p-Электроны двойной связи находятся над и под плоскостью, в которой расположены атомы этиленового фрагмента (см. рис. 6 лекция 2). Они могут быть относительно легко атакованы реагентами, имеющими недостаток электронной плотности (электрофилами). Сами алкены выступают в роли донора пары электронов. Таким образом, типичными реакциями алкенов являются реакции электрофильного присоединения (AE). Кроме того, алкены легко вступают в реакции присоединения с участием свободных радикалов (AR).
Не следует забывать, что кроме фрагмента двойной связи все алкены (исключение - этилен) содержат и алкильные группы, которые способны участвовать и реакциях замещения, описанных в разделе алканы.
Присоединение водорода (гидрирование)
Присоединение молекулы водорода по двойной связи - экзотермическая реакция, протекающая в отсутствие катализатора даже при повышенной температуре с низкой скоростью. В присутствии гетерогенного катализатора, роль которого заключается в понижении энергии активации, реакция способна протекать уже при комнатной температуре.
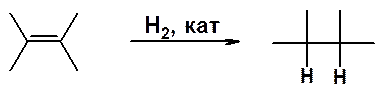
Используют платиновые, палладиевые или никелевые катализаторы. В промышленности чаще используют более дешевый никель.
Классическая качественная реакция на присутствие в молекуле двойной связи - обесцвечивание бромной воды или раствора брома в инертном растворителе при пропускании через него газообразного алкена.
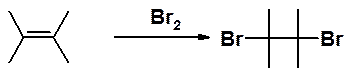
Механизм реакции присоединения брома к алкенам
Известные экспериментальные факты.
1. При проведении реакции в инертном растворителе (например, в тетрахлорметане) в результате реакции образуется исключительно 1,2-дибромэтан.
2. Если реакция проводится в бромной воде, образуются 1,2-дибромэтан, 2-бромэтанол и бромистый водород.
3. Если в растворе наряду с бромом содержится хлорид натрия, то в продуктах реакции фиксируется 1-бром-2-хлорэтан. Причем сам NaCl не реагирует с этиленом ни в каких условиях.
4. Если образуется соединение, в котором отсутствует вращение относительно углерод-углеродной связи, атомы галогена в нем занимают транс-положение.
Когда молекула галогена подходит к молекуле алкена, p-электроны последнего поляризуют связь в молекуле брома с образованием так называемого p-комплекса:

p-Электроны алкена все более сдвигаются к частично позитивированному атому брома, пока полностью не образуют с ним s-связь. В результате образуется карбокатион. Затем происходит перекрывание свободной пары электронов брома со свободной орбиталью карбокатионного центра. Образуются положительно заряженный бромониевый катион и анион брома. Это самая медленная стадия реакции.
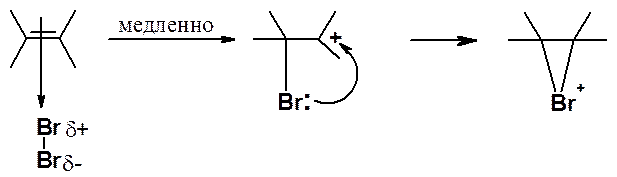
Образовавшийся катион быстро подвергается атаке анионом брома, причем образование связи C-Br происходит с противоположной стороны от Br+.
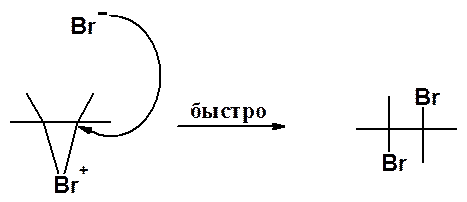
Присутствие в продуктах реакции бромэтанола и бромхлорэтана объясняет тем, что нуклеофильные реагенты, имеющиеся в реакционной смеси (вода, хлорид-анион), наряду с анионом брома вступают в конкурирующую реакцию с бромониевым катионом.
Транс-ориентацию заместителей в продуктах присоединения объясняет последняя стадия, в ходе которой нуклеофил атакует бромониевый катион с противоположной стороны от атома, несущего заряд.
По аналогичному механизму протекают все реакции электрофильного присоединения (AE). Если электрофил способен образовывать ониевый катион, считается, что реакция идет через циклический ониевый катион (не во всех случаях доказано). Если электрофил не может образовывать две связи (например, протон) – реакция идет через карбокатион.
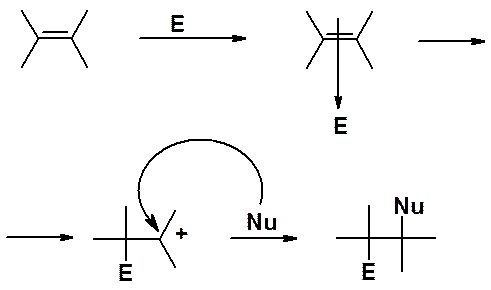
Первая стадия реакции всегда - атака электрофильной частицы на электроны p-связи с образованием катиона, который быстро присоединяет нуклеофил.
Алкены легко реагируют с галогеноводородами (кроме HF), образуя соответствующие галогенопроизводные алканов.
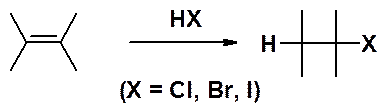
В случае взаимодействия галогеноводорода с несимметричным алкеном возникает вопрос региоориентации реакции, т.е. к какому атому углерода двойной связи присоединяется галоген, а какому - водород.
Например, присоединение бромистого водорода к пропилену может привести к 1-бромпропану или к 2-бромпорпану, либо к смеси этих продуктов. В эксперименте установлено, что преимущественно образуется 2-бромпропан с незначительной примесью 1-изомера.
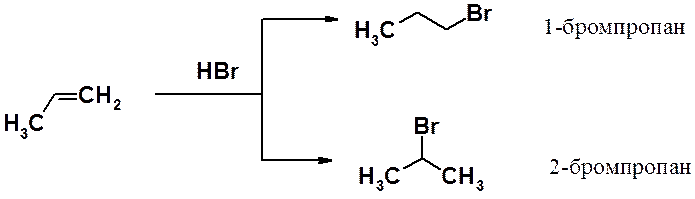
Еще в 1869 г. В. Марковников (Казанский университет) на основе большого числа экспериментальных фактов сформулировал эмпирическое правило:
“Реагент HX присоединяется к несимметричному олефину так, чтобы водород присоединился к наиболее гидрогенизованному (наименее замещенному), а X – к наименее гидрогенизованному (наиболее замещенному) атому углерода двойной связи”.
Таким образом, образование 2-бромпропана происходит в соответствии с правилом Марковникова.
В соответствии с изложенным выше общим механизмом, реакция начинается с атаки электрофильной частицы. В бромистом водороде электрофилом может быть только протон (Н+).
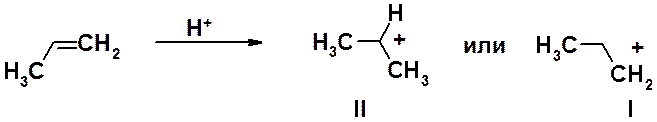
Присоединение протона к двойной связи может теоретически привести к одному из двух карбониевых катионов: первичному (I) или вторичному (II). На практике основной процесс – образование катиона II. Для объяснения этого факта рассмотрим ключевую стадию реакции – присоединение протона.
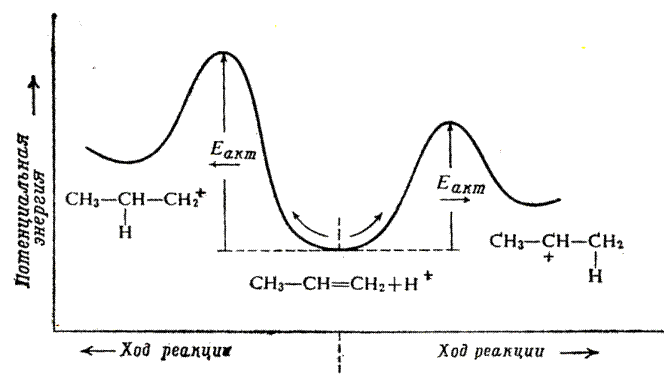
Рис. 9.1. Строение и устойчивость карбокатионов
В общем случае реакция определяется самым энергетически затратным местом на энергетической кривой. В реакции AE это – переходное состояние, возникающее в ходе присоединения протона. Переходное состояние не может быть зарегистрировано какими-либо физическими методами. Но для оценки его строения можно использовать постулат Хэмонда.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.