




































Химическая кинетика и термодинамика
(краткий конспект лекций)
1.1. Основные понятия
Термодинамические параметры – величины, характеризующие состояние термодинамической системы (давление P, температура T, объем V и др.)
Различные термодинамические системы: изолированная (не обменивается энергией и веществом с другими системами), открытая (обменивается энергией и веществом), закрытая (обменивается только энергией), адиабатная (не обменивается теплом).
При постоянных внешних условиях любая термодинамическая система со временем приходит в равновесное состояние, характеризующееся неизменностью во времени термодинамических параметров и отсутствием в системе потоков вещества и энергии.
Термодинамический процесс – изменение состояния системы, характеризующееся изменением ее термодинамических параметров.
Равновесный процесс – процесс, рассматриваемый как непрерывный ряд равновесных состояний системы.
Обратимый термодинамический процесс – процесс, после которого система и окружающая среда могут возвратиться в начальное состояние. Равновесный процесс всегда обратим, а обратимый процесс всегда протекает равновесным путем.
Различные термодинамические процессы: адиабатический (без обмена теплотой с внешней средой), изохорный (V= const), изобарный (P= const), изотермический (T= const).
Функция состояния – функция, которая определяется только параметрами системы и не зависит от пути перехода системы в то или иное состояние. Например, функция состояния идеального газа:
![]() (1.1)
(1.1)
где P – давление, Па; V – объем, м3; n – число молей; R =8.31451 Дж/(моль K) – газовая постоянная; T – температура, K.
Для произвольной функции
двух переменных ![]() :
:
![]() (1.2)
(1.2)
Если ![]() полный
дифференциал, то
полный
дифференциал, то ![]() - функция состояния. Критерий
функции состояния – выполнение условия полного дифференциала:
- функция состояния. Критерий
функции состояния – выполнение условия полного дифференциала:
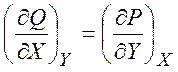 (1.3)
(1.3)
1.2. Первое начало термодинамики
В термодинамике основными формами передачи энергии являются работа W и теплота Q.
Работа – энергия, не зависящая от температуры и не связанная с переносом вещества:
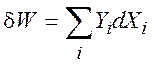
где Yi - обобщенная сила (давление, пр.); Xi – обобщенная координата (объем, пр.). работа считается положительной, если она совершается системой.
Теплота– энергия, зависящая только от температуры, и не связанная с переносом вещества. Работа при этом не свершается. Теплота считается положительной, если энергия поступает в систему.
Внутренняя энергия системы – функция состояния системы, характеризующаяся тем, что ее приращение в любом процессе равно разности теплоты, сообщенной системе, и работы, совершенной системой:
![]() (1.4)
(1.4)
Равенство (1.4) является математическим выражением первого начала термодинамики (закон сохранения энергии).
Внутренняя энергия представляет собой совокупность всех видов энергии в системе:
![]() (1.5)
(1.5)
где Екин – кинетическая энергия движения молекул; Еколеб – колебательная энергия молекул; Евр – вращательная энергия молекул; Есв – энергия химических связей в молекулах. Кинетическая и потенциальная энергия системы как целого не входят во внутреннюю энергию.
![]() (1.6)
(1.6)
где ![]() - работа сверх работы расширения
(полезная работа). Если полезная работа не совершается, то первое
начало термодинамики
- работа сверх работы расширения
(полезная работа). Если полезная работа не совершается, то первое
начало термодинамики
![]() (1.7)
(1.7)
Для адиабатического процесса ![]() , и
, и
![]() (1.8)
(1.8)
Для изохорного процесса V=const, и ![]() является
полным дифференциалом:
является
полным дифференциалом:
![]() (1.9)
(1.9)
Для изобарного процесса P=const, и ![]() является
полным дифференциалом:
является
полным дифференциалом:
![]() (1.10)
(1.10)
Функция H является функцией состояния и называется энтальпией (теплосодержанием):
![]() (1.11)
(1.11)
Теплоемкость системы:
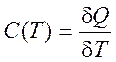 (1.12)
(1.12)
при постоянном давлении:
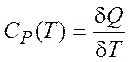 (1.13)
(1.13)
при постоянном объеме:
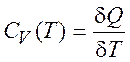 (1.14)
(1.14)
1.3. Энтропия. Второе и третье начала термодинамики
Некоторые термодинамические процессы могут протекать в отсутствии устройств для получения работы. Такие процессы называют самопроизвольными процессами (например, передача тепла от горячего тела к холодному, химическая реакция и пр.). При этом, если система изолирована, конечное состояние не является более выгодным по энергии (полная энергия изолированной системы не меняется). В ходе самопроизвольного процесса система из состояния с меньшей вероятностью реализации переходит в состояние с большей вероятностью.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.