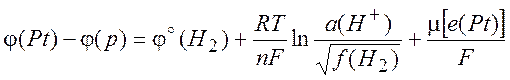 (10.2)
(10.2)
где
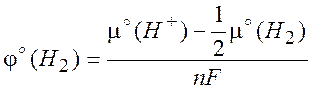 (10.3)
(10.3)
представляет собой стандартный электродный потенциал водородного электрода, принимаемый равным нулю для указанных выше стандартных условий. Величину
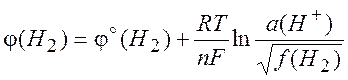 (10.4)
(10.4)
называют потенциалом полуэлемента, или электродным потенциалом. Эту величину записывают в общем виде
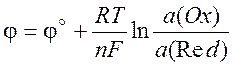 (10.5)
(10.5)
10.3. Напряжение гальванического элемента
Гальванический элемент – два электрода, соединенные проводником. Напряжение гальванического элемента – это предельное значение разности электродных потенциалов, при токе через элемент, стремящемся к нулю.
Например, гальванический элемент из двух электродов первого рода:
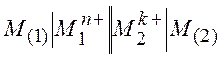
Исходя из общей формулы (10.5), запишем выражения для потенциалов обоих электродов:
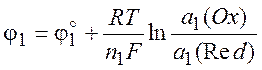
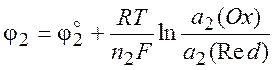
Напряжение гальванического элемента:
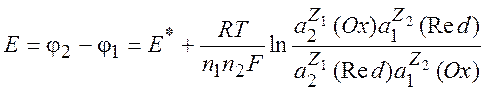 (10.6)
(10.6)
где
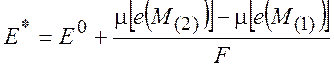 (10.7)
(10.7)
Величину E0 называют стандартной разностью электродных потенциалов:
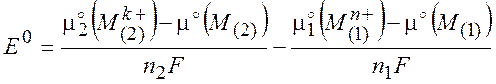 (10.8)
(10.8)
Уравнение (10.6) называется уравнением Нернста.
10.4. Распределение и потоки ионов через мембрану
Движение ионов через полупроницаемую мембрану может привести к возникновению разности электрических потенциалов на мембране, из за разной проницаемости мембраны для разных ионов. Эта разность потенциалов влияет на равновесное распределение других ионов, переносимых через мембрану.
Рассмотрим раствор, содержащий
ионы X+ и Y -,
разделенный мембраной на две части (1) и (2), каждая из которых характеризуется
концентрациями ионов и своим электрическим потенциалом: (![]() ,
,![]() ,
,![]() )
и (
)
и (![]() ,
,![]() ,
,![]() ).
Выпишем выражения для химического потенциала катиона в первой и во второй части
системы:
).
Выпишем выражения для химического потенциала катиона в первой и во второй части
системы:
![]() (10.9)
(10.9)
![]() (10.10)
(10.10)
В равновесии выполняется равенство химических потенциалов:
![]()
![]()
откуда следует, что
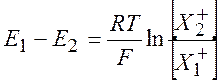 (10.11)
(10.11)
Аналогично, для аниона ![]() :
:
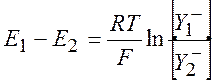 (10.12)
(10.12)
Сравнивая уравнения (10.11) и (10.12), получаем
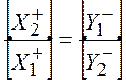 (Доннаново
равновесие) (10.13)
(Доннаново
равновесие) (10.13)
Глава 11. Адсорбция
11.1. Поверхностная адсорбция
Физическая адсорбция – происходит за счет дисперсионных (ван-дер-ваальсовых) взаимодействий молекул, образования водородных связей и других сил электростатического характера. Характерная теплота адсорбции 2-5 кДж/моль.
Химическая адсорбция – происходит за счет образования химических связей. Характерная теплота адсорбции 10 кДж/моль.Может сопровождаться диссоциацией молекул адсорбата и другими его химическими превращениями.
11.2. Изотерма адсорбции Ленгмюра
Рассмотрим процесс адсорбции с учетом степени заполнения монослоя на поверхности:
![]()
Если Nп- полное число мест на поверхности, и ![]() - степень заполнения поверхности, то
константа равновесия равна
- степень заполнения поверхности, то
константа равновесия равна
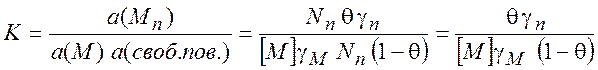 (11.1)
(11.1)
где ![]() - концентрация
адсорбата (вещества M)
в среде,
- концентрация
адсорбата (вещества M)
в среде, ![]() - коэффициент активности адсорбата в
среде,
- коэффициент активности адсорбата в
среде, ![]() - коэффициент активности поверхностных
молекул. Уравнение (11.1) можно преобразовать к виду
- коэффициент активности поверхностных
молекул. Уравнение (11.1) можно преобразовать к виду
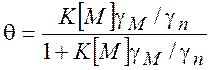 (изотерма
Ленгмюра) (11.2)
(изотерма
Ленгмюра) (11.2)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.