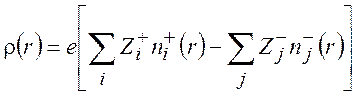 (9.7)
(9.7)
Используя уравнения (9.5) и (9.6), получаем
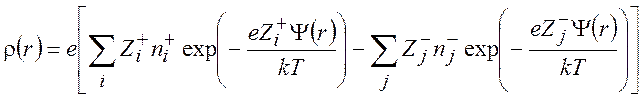 (9.8)
(9.8)
Разлагая экспоненты в выражении (9.8) в ряд и ограничиваясь в каждом разложении двумя слагаемыми, а также учитывая электронейтральность раствора
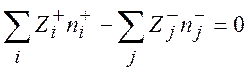 (9.9)
(9.9)
получаем
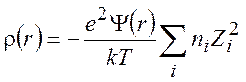 (9.10)
(9.10)
где суммирование распространено на все катионы и анионы, присутствующие в растворе. Подставляя (9.10) в (9.4), находим
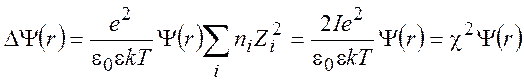 (9.11)
(9.11)
Величина I называется ионной силой раствора:
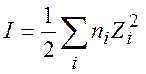 (9.12)
(9.12)
9.2. Решение уравнения Пуассона
Уравнение Пуассона (9.11) называется уравнением Дебая-Хюккеля. В случае сферической симметрии это уравнение принимает вид:
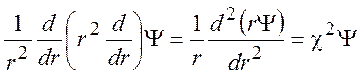 (9.13)
(9.13)
Решение этого уравнения известно:
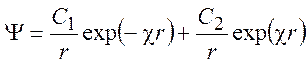 (9.14)
(9.14)
![]() при
при ![]() ,
поэтому C2 = 0. Постоянную C1 можно найти из условия, что при
,
поэтому C2 = 0. Постоянную C1 можно найти из условия, что при ![]() величина
величина ![]() стремится
к потенциалу точечного заряда. Тогда
стремится
к потенциалу точечного заряда. Тогда
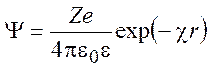 (9.15)
(9.15)
Величину ![]() называют радиусом
ионной атмосферы.
называют радиусом
ионной атмосферы.
9.2. Коэффициент активности ионов
Разность ![]() равна
работе по отключению взаимодействий. Величина межионного взаимодействия
определяется энергией взаимодействия со своей ионной атмосферой. Для расчета
энергии этого взаимодействия найдем электростатический потенциал
равна
работе по отключению взаимодействий. Величина межионного взаимодействия
определяется энергией взаимодействия со своей ионной атмосферой. Для расчета
энергии этого взаимодействия найдем электростатический потенциал ![]() , который создается только за счет ионной
атмосферы:
, который создается только за счет ионной
атмосферы:
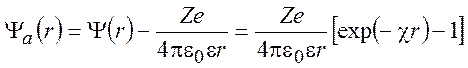 (9.16)
(9.16)
Потенциал, создаваемый ионной атмосферой в центре координат:
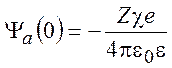
В процессе включения межионных взаимодействий энергия взаимодействия определяется выражением:
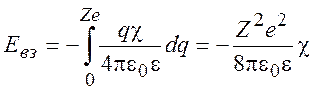 (9.17)
(9.17)
Мольная энергия взаимодействия равна
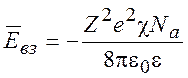 (9.18)
(9.18)
Следовательно,
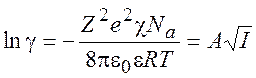 (9.19)
(9.19)
9.3. Теория Дебая-Хюккеля во втором приближении
Теория Дебая-Хюкеля позволяет учитывать конечные размеры ионов. Пусть ион представляет собой сферу радиусом a. Решение Пуассона сохраняется:
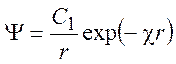
Величину константы C1 будем определять из условия, что напряженность электрического поля на границе ион-раствор не зависит от способа вычисления:
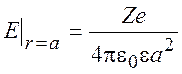
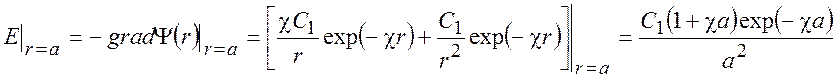
В результате получаем:
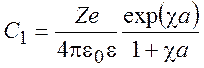 (9.20)
(9.20)
Повторяя предыдущие рассуждения, для ![]() находим
находим
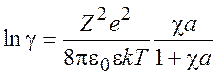 (9.21)
(9.21)
9.3. Среднеионный коэффициент активности
В растворах электролитов невозможно изменять концентрацию только катионов, не меняя при этом концентрацию анионов. Поэтому экспериментальные данные позволяют определить только среднеионный коэффициент активности.
Рассмотрим электролит типа MmLl, диссоциирующий на ионы по уравнению
![]() (9.22)
(9.22)
Энергия Гиббса исходной соли, растворенной в числе n молей и имеющую концентрацию C:
![]() (9.23)
(9.23)
Энергию Гиббса этой же соли в растворе можно записать через химические потенциалы отдельных ионов:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.