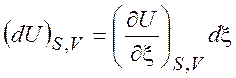 =
= 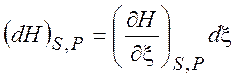 =
= 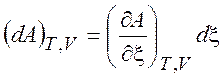 = =
= =
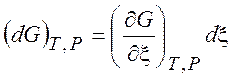 =
= 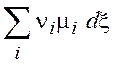 (
(![]() - хим.
потенциал) (3.9)
- хим.
потенциал) (3.9)
Химическое сродство реакции Ar:
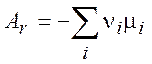 (характеризует
степень отклонения от равновесия) (3.10)
(характеризует
степень отклонения от равновесия) (3.10)
в равновесии
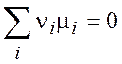 (условие равновесия)
(3.11)
(условие равновесия)
(3.11)
Парциальная мольная величина:
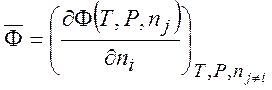 (3.12)
(3.12)
где ![]() - любая
экстенсивная (аддитивная) функция. Например, энергия Гиббса:
- любая
экстенсивная (аддитивная) функция. Например, энергия Гиббса:
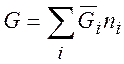 (3.13)
(3.13)
Только для энергии Гиббса парциальная мольная величина совпадает с химическим потенциалом:
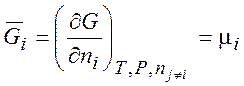 (3.14)
(3.14)
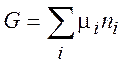 (3.15)
(3.15)
Глава 4. Равновесие в системе идеальных газов
4.1. Расчет химического потенциала вещества
Для расчета ![]() используют обычно энергию Гиббса
(стандартные переменные T
и P) . Вычисление изменения энергии
Гиббса для одного моля вещества в два этапа:
используют обычно энергию Гиббса
(стандартные переменные T
и P) . Вычисление изменения энергии
Гиббса для одного моля вещества в два этапа:
1) вычисление химического
потенциала чистого вещества в стандартном состоянии, ![]() или
или
![]() ;
;
2) расчет химического
потенциала вещества в исследуемой системе, ![]() .
.
![]() (4.1)
(4.1)
При расчете величин ![]() и
и ![]() необходимо учитывать существование фазовых
переходов, например:
необходимо учитывать существование фазовых
переходов, например:
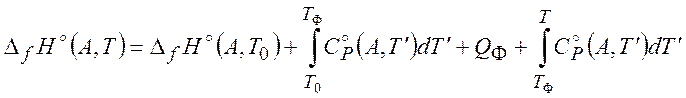
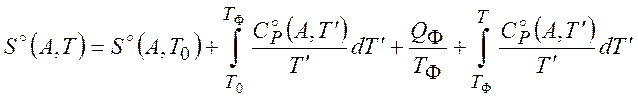
Второй этап расчета химического потенциала будет обсужден при рассмотрении конкретных случаев.
4.2. Химический потенциал идеального газа
Уравнение состояния идеального газа
![]()
Проинтегрируем уравнение
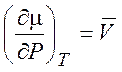 (4.2)
(4.2)
Получаем
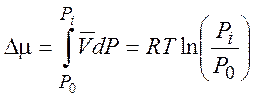 (4.3)
(4.3)
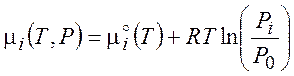 (4.4)
(4.4)
где
![]() (4.5)
(4.5)
4.3. Константа равновесия химической реакции
Рассмотрим газофазную химическую реакцию
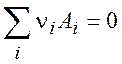
находящуюся в состоянии равновесия. Воспользуемся уравнением (3.11) и подставим в него выражение (4.4):
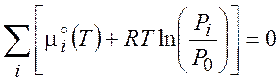 (4.6)
(4.6)
Тогда в состоянии равновесия
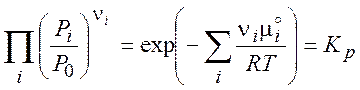 (закон
действующих масс) (4.7)
(закон
действующих масс) (4.7)
Величина KP называется константой
равновесия. Стандартное изменение энергии Гиббса в химической реакции ![]() :
:
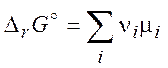 (4.8)
(4.8)
5.1. Уравнение состояния реальных газов
Уравнение Ван-дер-Ваальса применимо для газов и жидкости, но для не очень высоких давлений:
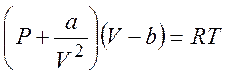 (5.1)
(5.1)
Уравнение Битти-Бриджмена применимо для реальных газов в шмроком диапазоне параметров:
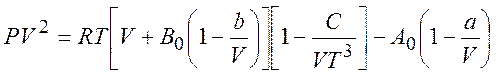 (5.2)
(5.2)
Уравнение Бертло использует критические параметры газа Tкри Pкр :
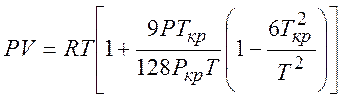 (5.3)
(5.3)
В настоящее время предпочитают описывать свойства реальных газов с помощью вириальных коэффициентов в виде:
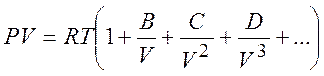 (5.4)
(5.4)
Коэффициенты зависят от температуры, например
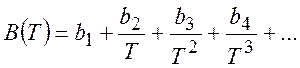
Температура, при которой ![]() ,
называется температурой Бойля.
,
называется температурой Бойля.
5.2. Летучесть
Определение летучести f :
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.