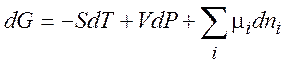 (1.38)
(1.38)
Уравнения (1.35) – (1.38) описывают термодинамику обратимых и необратимых процессов в системах любого типа (открытых, закрытых, изолированных). Соотношения, аналогичные соотношениям Максвелла:
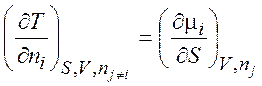 ,
, 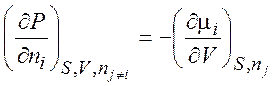 ,
,
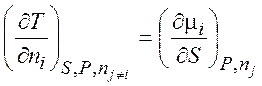 ,
, 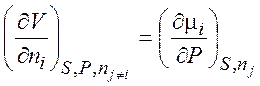 , (1.39)
, (1.39)
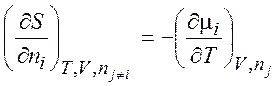 ,
, 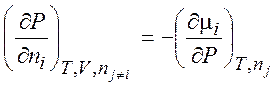 ,
,
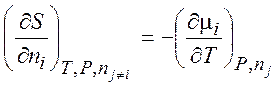 ,
, 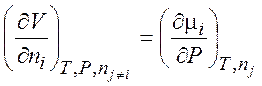 .
.
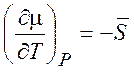 ,
, 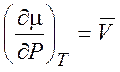 (на один моль вещества) (1.40)
(на один моль вещества) (1.40)![]() (1.41)
(1.41)
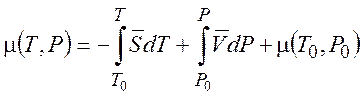 (1.42)
(1.42)
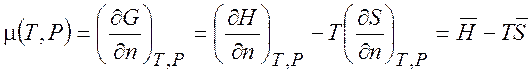 (1.43)
(1.43)
![]() (начало отсчета)
(1.44)
(начало отсчета)
(1.44)
Для выбора начала отсчета устанавливаются стандартные состояния и стандартные условия (см. ниже).
Глава 2. Термодинамическое описание химических процессов
2.1. Химическая переменная
Пусть в системе протекает одна химическая реакция:
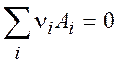 (2.1)
(2.1)
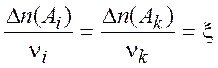 -
химическая переменная (2.2)
-
химическая переменная (2.2)
![]() (2.3)
(2.3)
В случае нескольких реакций:
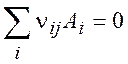 (2.4)
(2.4)
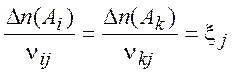 (2.5)
(2.5)
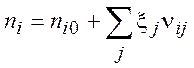 (2.6)
(2.6)
2.2. Стандартные состояния и стандартные условия
В химических реакциях
элементы друг в друга не превращаются. Поэтому в качестве нуля отсчета (базиса)
берут совокупность всех химических элементов (базисные вещества)
в виде простых веществ, находящихся в наиболее устойчивых формах при 25о
С. Исключения: фосфор берут в виде соединения P4 (белый фосфор), а олово в состоянии ![]() - олово (белое олово).
- олово (белое олово).
Стандартное состояние:
1) T = T (системы);
2) давление над веществом или давление газообразного вещества P= P0 = 1 бар (1 бар = 105 Па);
3) для газообразного вещества выбирают гипотетическое состояние в виде идеального газа.
Обозначения: ![]() ,
…
,
…
Если в стандартном состоянии T = 298.15o K (25o C), то это стандартные условия.
2.3. Стандартные термодинамические величины образования веществ
![]() -
стандартная энтальпия образования вещества A, - это изменение энтальпии в реакции
-
стандартная энтальпия образования вещества A, - это изменение энтальпии в реакции
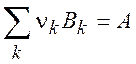 (2.7)
(2.7)
где Bk – базисные вещества в стандартных условиях.
Стандартные термодинамические величины образования при стандартных условиях:
![]() ,
,
![]() ,
, ![]()
Для расчета значений термодинамических параметров при другой температуре, в справочниках проводится зависимость теплоемкости различных веществ от температуры при стандартном давлении 1 атм. Например:
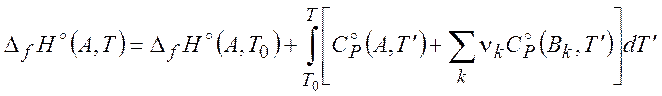 (
(![]() ) (2.8)
) (2.8)
где изменение стандартной теплоемкости в реакции
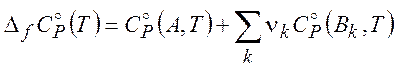 (2.9)
(2.9)
Для вычисления ![]() и
и ![]() можно
использовать следующие формулы:
можно
использовать следующие формулы:
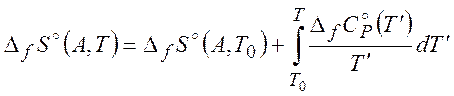 (2.10)
(2.10)
![]() (2.11)
(2.11)
где
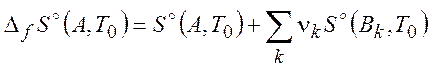 (
(![]() ) (2.12)
) (2.12)
Эмпирические формулы зависимости теплоемкости от температуры обычно представляют в виде
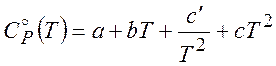 (2.13)
(2.13)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.