Мерой числа способов (![]() ) реализации состояния системы является энтропия:
) реализации состояния системы является энтропия:
![]() (1.15)
(1.15)
где ![]() =1.380662
=1.380662
![]() 10-23 Дж/К (постоянная
Больцмана). Так как число способов реализации состояния системы не зависит от
пути перехода в это состояние, то энтропия является функцией состояния системы.
10-23 Дж/К (постоянная
Больцмана). Так как число способов реализации состояния системы не зависит от
пути перехода в это состояние, то энтропия является функцией состояния системы.
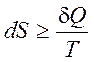 (1.16)
(1.16)
Выражение (1.16) является математической формулировкой второго начала термодинамики.
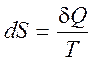 (1.17)
(1.17)
При T= 0 существует только один способ реализации состояния системы (третье начало термодинамики):
![]() (1.18)
(1.18)
Выражая ![]() из
(1.16) и подставляя в (1.7) получаем основное термодинамическое равенство:
из
(1.16) и подставляя в (1.7) получаем основное термодинамическое равенство:
![]() (1.19)
(1.19)
1.4. Термодинамические потенциалы
Внутренняя энергия ![]() является термодинамическим потенциалом
(изохорно-изоэнтропийный потенциал). Естественными переменными для внутренней
энергии
является термодинамическим потенциалом
(изохорно-изоэнтропийный потенциал). Естественными переменными для внутренней
энергии ![]() являются
являются ![]() и
и ![]() . Другие термодинамические потенциалы:
. Другие термодинамические потенциалы:
![]() -
энтальпия (теплосодержание), изобарно-изоэнтропийный потенциал;
-
энтальпия (теплосодержание), изобарно-изоэнтропийный потенциал;
![]() -
свободная энергия (энергия Гельмгольца), изохорно-изотермический
потенциал;
-
свободная энергия (энергия Гельмгольца), изохорно-изотермический
потенциал;
![]() -
энергия Гиббса, изобарно-изотермический потенциал.
-
энергия Гиббса, изобарно-изотермический потенциал.
Для дифференциалов этих функций:
![]() (1.20)
(1.20)
![]() (1.21)
(1.21)
![]() (1.22)
(1.22)
1.5. Термодинамические соотношения между величинами
Из равенств (1.19) - (1.22) можно получить следующие термодинамические соотношения (соотношения Максвелла)
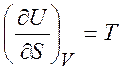 ,
,
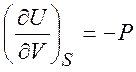 ,
, 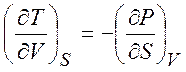 ,
,
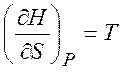 ,
,
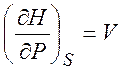 ,
, 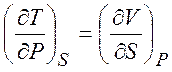 ,
(1.23)
,
(1.23)
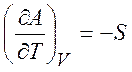 ,
,
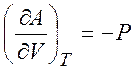 ,
, 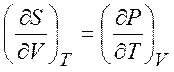 ,
,
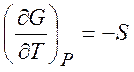 ,
,
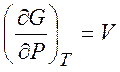 ,
, 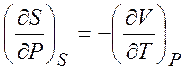 ,
,
и выражения для теплоемкостей
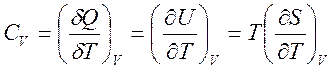 ,
, 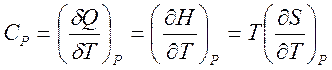 , (1.24)
, (1.24)
и уравнения Гиббса-Гельмгольца
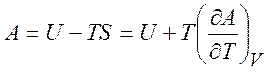 ,
, 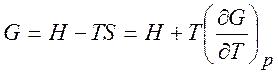 . (1.25)
. (1.25)
Термодинамические соотношения можно получать также путем замены переменных, используя якобианы:
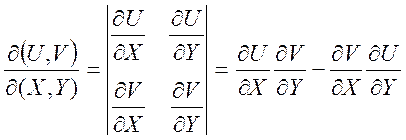 (1.26)
(1.26)
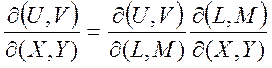 (1.27)
(1.27)
Можно показать, что:
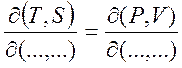 (1.28)
(1.28)
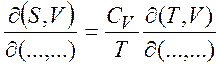 (1.29)
(1.29)
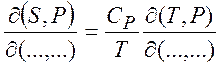 (1.30)
(1.30)
Пример:
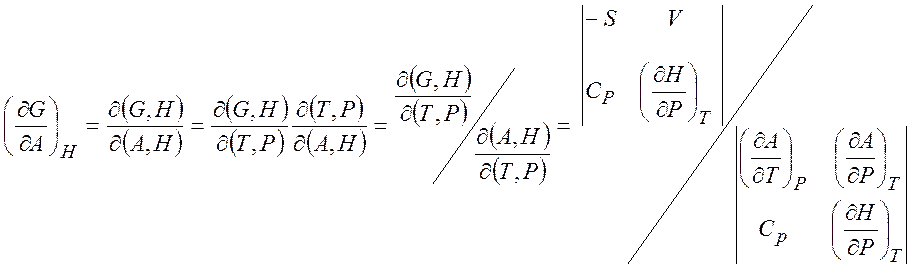
1.6. Химический потенциал
Рассмотрим
термодинамическую систему с переменным числом частиц ![]() :
:
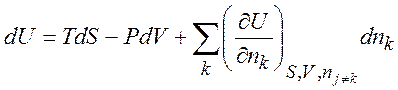 (1.31)
(1.31)
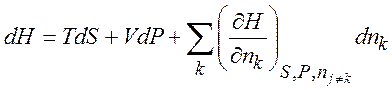 (1.32)
(1.32)
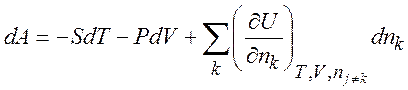 (1.33)
(1.33)
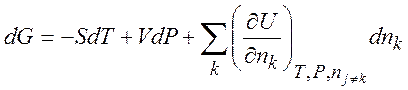 (1.34)
(1.34)
Исходя из определения dH, dAи dG , получаем:
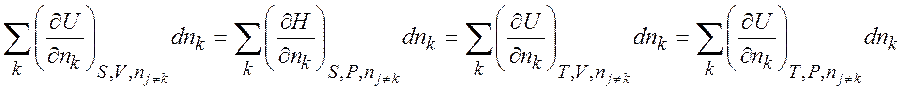
откуда следует, что
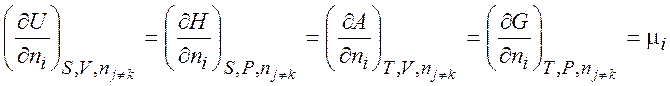 (хим. потенциал)
(хим. потенциал)
итак,
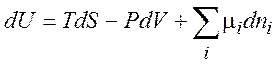 (1.35)
(1.35)
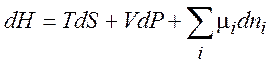 (1.36)
(1.36)
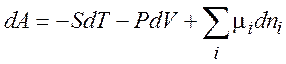 (1.37)
(1.37)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.