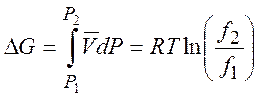 (5.5)
(5.5)
Для идеального газа летучесть равна давлению. Для реального газа:
![]() (5.6)
(5.6)
где ![]() -
коэффициент летучести. При очень малом давлении P*
-
коэффициент летучести. При очень малом давлении P*
![]()
Поэтому изменение энергии Гиббса при переходе от идеального газа к реальному:
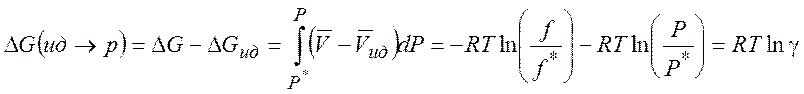 (5.7)
(5.7)
Используя (5.7) можно рассчитать изменение различных термодинамических параметров в процессе перехода от (гипотетического) идеального газа к реальному (при T = const и P= const) :
![]() (5.8)
(5.8)
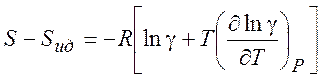 (5.9)
(5.9)
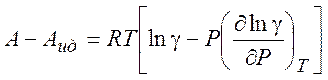 (5.10)
(5.10)
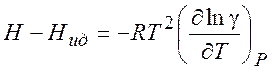 (5.11)
(5.11)
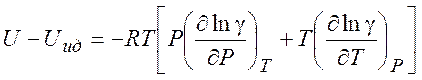 (5.12)
(5.12)
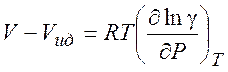 (5.13)
(5.13)
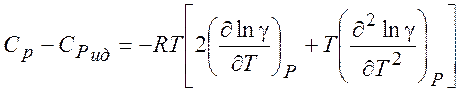 (5.14)
(5.14)
Если известно уравнение состояния реального газа, величину f нетрудно рассчитать, используя уравнение
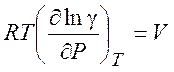 (5.15)
(5.15)
или уравнение
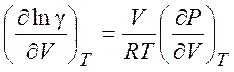 (5.16)
(5.16)
5.3. Химический потенциал реального газа
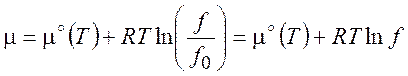 (5.17)
(5.17)
где стандартное состояние ![]() =1 бар (гипотетическое состояние идеального
газа при f0 = P0 = 1 бар, в
которое система может попасть в результате гипотетического равновесного
выключения межмолекулярных взаимодействий).
=1 бар (гипотетическое состояние идеального
газа при f0 = P0 = 1 бар, в
которое система может попасть в результате гипотетического равновесного
выключения межмолекулярных взаимодействий).
5.3. Химическое равновесие в смеси реальных газов
В смеси реальных газов летучесть газа будет зависеть не только от его собственной концентрации, но и от химической природы и количества других газов. Однако, для практических расчетов часто используется приближенное правило Льюиса и Ренделла:
![]() (5.18)
(5.18)
где ![]() -
коэффициент летучести чистого i-го
газа при давлении, равном полному давлению P в смеси. Тогда для равновесной ситуации имеем
следующую константу равновесия:
-
коэффициент летучести чистого i-го
газа при давлении, равном полному давлению P в смеси. Тогда для равновесной ситуации имеем
следующую константу равновесия:
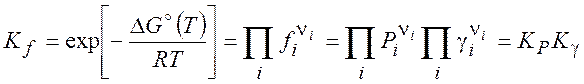 (5.19)
(5.19)
Обычно полагают, что парциальное давление газа в смеси прямо пропорционально его мольной доле:
![]() (5.20)
(5.20)
5.4. Активность
Активностью называется отношение летучести в реальном состоянии к летучести в стандартном состоянии при одинаковой температуре:
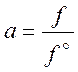 (5.21)
(5.21)
Для газов ![]() ,
поэтому для них
,
поэтому для них
![]()
Глава 6. Теория равновесия гетерогенных систем
6.1. Условия равновесия в гетерогенной системе
Рассмотрим термодинамическую систему, состоящую из Ф фаз и К компонентов. Предполагается, что внешние поля отсутствуют, а границы раздела фаз – плоские. Считаем, что равновесная многокомпонентная система характеризуется условиями T = const и P = const. В равновесии потенциал Гиббса имеет минимальное значение. В многофазной системе его значение складывается из энергий Гиббса отдельных фаз:
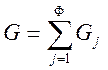 (6.1)
(6.1)
![]()
При постоянных T, P находим
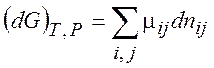 (6.2)
(6.2)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.