![]() (9.24)
(9.24)
Это же выражение можно записать через среднеионный
коэффициент активности ![]() :
:
![]() (9.25)
(9.25)
Сравнивая (9.23) и (9.25), получаем выражение для активности соли
![]() (9.26)
(9.26)
где среднеионный коэффициент активности
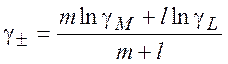 (9.27)
(9.27)
Используя выражение для коэффициентов активности ионов из теории Дебая-Хюккеля, можно получить уравнение Дебая-Хюккеля для среднеионного коэффициента активности:
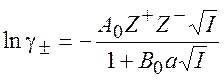 (9.28)
(9.28)
Если член ![]() мал
по сравнению с единицей, то получаем предельное уравнение Дебая-Хюккеля:
мал
по сравнению с единицей, то получаем предельное уравнение Дебая-Хюккеля:
![]() (9.29)
(9.29)
9.4. Влияние ионной силы на степень электролитической диссоциации
Рассмотрим диссоциацию слабого электролита
![]()
Константа равновесия этой реакции равна
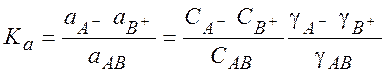 (9.30)
(9.30)
Обычно предполагают. Что коэффициенты активности ![]() и
и ![]() зависят
отионной силы, в то время как коэффициент активности
зависят
отионной силы, в то время как коэффициент активности ![]() нейтральной
молекулы – нет.
нейтральной
молекулы – нет.
9.5. Стандартное состояние ионов в растворах
В качестве стандартного состояния для растворов электролитов принято выбирать гипотетический раствор с единичной концентрацией (например, 1 моль/л), в котором электростатическое взаимодействие ионов отсутствует. В качестве начала отсчета термодинамических величин принимают, что для иона H+ в водном растворе при 25 0С
![]() ,
,
![]() ,
, ![]()
9.6. Кислотно-основные равновесия
Кислота – вещество, молекулы которого способны отдавать протон другим молекулам.
![]()
Основание – вещество, молекулы которого способны принимать протон от других молекул.
![]()
![]()
9.6. Диссоциация воды
Чистая вода является одновременно слабой кислотой и слабым основанием:
![]()
Константа равновесия этой реакции
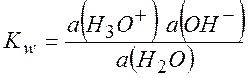
Обычно считают, что в разбавленных
водных растворах ![]() мало отличается от единицы, и тогда
мало отличается от единицы, и тогда
![]() (ионное
произведение воды) (9.31)
(ионное
произведение воды) (9.31)
Считая, что отличие концентраций от активностей мало, можно записать
![]()
Величина ![]() хорошо
известна при разных температурах. При 25 0C
хорошо
известна при разных температурах. При 25 0C
![]() моль2/л2
моль2/л2
чистой воде при 25 0C :
![]() моль/л
моль/л
Активность иона водорода ![]() обычно измеряют в шкале водородного
показателя pH:
обычно измеряют в шкале водородного
показателя pH:
![]() (9.32)
(9.32)
Если концентрация невелика, то можно пренебречь различием концентраций и активностей, и положить:
![]() (9.33)
(9.33)
9.7. Диссоциация кислот и оснований
Диссоциация кислоты:
![]()
Константа диссоциации в приближении малого отличия концентраций от активностей:
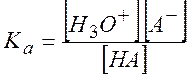 (9.34)
(9.34)
Аналогично в случае основания:
![]()
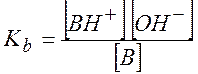 (9.35)
(9.35)
По аналогии с pH константы равновесия для кислот (pKa) и оснований (pKb):
![]() ,
, ![]() (9.36)
(9.36)
Сильные кислоты и основания – такие соединения, который нацело диссоциируют при любых концентрациях (например, HCl, KOH и др.). Слабые кислоты и основания дииссоциируют не полностью (например, CH3COOH и др.).
9.8. Буферные растворы
Растворы слабых кислот (оснований) с солями этих же кислот (оснований), но с катионом сильных оснований (кислот) образуют буферные растворы. В буферных растворах pH слабо реагирует на разбавление и на добавки кислот и оснований.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.