Типичная буферная смесь: ![]() с концентрациями около 0.1 моль/л. В этом
случае концентрация аниона практически полностью определяется исходной
концентрацией соли, которая нацело продиссоциирована, а концентрация
непродиссоциированной формы кислоты практически полностью определяестя исходной
концентрацией кислоты. В итоге получаем:
с концентрациями около 0.1 моль/л. В этом
случае концентрация аниона практически полностью определяется исходной
концентрацией соли, которая нацело продиссоциирована, а концентрация
непродиссоциированной формы кислоты практически полностью определяестя исходной
концентрацией кислоты. В итоге получаем:
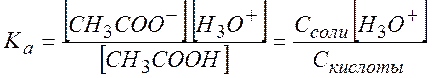 (9.37)
(9.37)
Отсюда
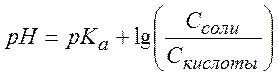 (уравнение
Гендерсона) (9.38)
(уравнение
Гендерсона) (9.38)
Глава 10. Электрохимические элементы
10.1. Классификация электродов
Электрод – проводник, погруженный в электролит. Каждый электролит характеризуется электродным межфазным потенциалом – разностью напряжений между электродом и электролитом.
Электроды первого рода – системы, у которых значение электродных потенциалов зависит от активности окисленной (или восстановленной) формы. Например, Ag помещенный в раствор AgNO3 : на электроде происходит реакция
![]()
К электродам первого рода относится также водородный электрод: черненая платина, погруженная в раствор кислоты и обдуваемая потоком газообразного водорода. На электроде происходит реакция
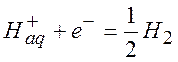 (газ)
(газ)
Потенциал водородного электрода, у которого активность ионов водорода равна единице и летучесть газообразного водорода равна 1 бар, принимается на нуль отсчета стандартных электрохимических потенциалов (нормальный водородный электрод, НВЭ). Принята следующая запись для электродов первого рода: Mn+,M0 или Mn+|M0, где Mn+ - окисленная форма (Ox), M0 – восстановленная форма (Red) вещества электрода.
Электроды второго рода – системы, у которых значение электродных потенциалов не зависит от активности окисленной и восстановленной формы металла, а определяется активностью анионов, не принимающих участие в окислительно-восстановительных превращениях. Такие электроды состоят из металла, покрытого его труднорастворимой солью и погруженного в раствор, содержащий анионы этой соли. Например, хлорсеребрянный электрод, который представляет собой металлическое серебро, покрытое осадком хлорида серебра и погруженное в раствор, содержащий анионы хлора. На этом электроде происходит окислительно-восстановительная реакция
![]()
Для электродов второго рода принята запись M0,MnXm,X -
Электроды третьего рода – системы, у которых значение электродного потенциала не зависит от активности окисленной и восстановленной формы, а определяется активностью катиона в растворе. Этот электрод состоит из металла, на котором осажены две труднорастворимые соли. Например, серебро, покрытое сначала хлоридом серебра, а затем хлоридом цинка; электрод погружен в раствор PbNO3 . На этом электроде идет процесс
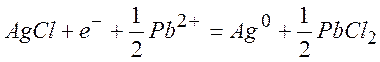
Для электродов третьего рода принята
запись 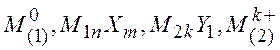
![]()
При обозначении
окислительно-восстановительного электрода указывают на природу нейтрального
металла в виде Ox, Red (Pt). Например ![]() .
.
10.2. Механизм образования электродных потенциалов
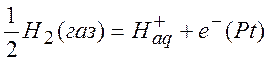
При этом металлическая платина заряжается отрицательно, а раствор – положительно. H+ , покидая платину, совершает работу против электрических сил. В равновесии
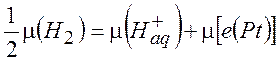 (10.1)
(10.1)
где ![]() - химический потенциал
электрона в платине. Раскрывая это выражение, получим
- химический потенциал
электрона в платине. Раскрывая это выражение, получим
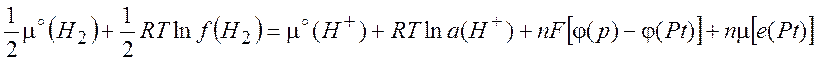
где ![]() и
и ![]() - электрический
потенциал раствора и платинового электрода, соответственно;
- электрический
потенциал раствора и платинового электрода, соответственно; ![]() - летучесть газообразного водорода;
- летучесть газообразного водорода; ![]() -
активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в
реакции; F – число Фарадея (F= eNa = 96485 Кл/моль). Для разности
потенциалов находим
-
активность катионов водорода в растворе; n – заряд протона или число электронов, участвующих в
реакции; F – число Фарадея (F= eNa = 96485 Кл/моль). Для разности
потенциалов находим
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.