 Однако эти выводы имеют отношение не только
к иону
Однако эти выводы имеют отношение не только
к иону ![]() и не только к основным состояниям. Хотя
рассмотренная одноэлектронная обменная связь, имеющая место в ионе
и не только к основным состояниям. Хотя
рассмотренная одноэлектронная обменная связь, имеющая место в ионе ![]() , и существует в природе, она достаточно
слаба и не является универсальной связью. Универсальная ковалентная связь
всегда обусловлена обменным взаимодействием, в котором принимают участие два
электрона. Самой простой молекулой, в которой реализуется ковалентная связь в
своем классическом варианте, является молекула водорода
, и существует в природе, она достаточно
слаба и не является универсальной связью. Универсальная ковалентная связь
всегда обусловлена обменным взаимодействием, в котором принимают участие два
электрона. Самой простой молекулой, в которой реализуется ковалентная связь в
своем классическом варианте, является молекула водорода ![]() .
Поскольку мы уже рассмотрели основное состояние иона
.
Поскольку мы уже рассмотрели основное состояние иона ![]() , то нам достаточно легко будет
проанализировать основное электронное состояние молекулы
, то нам достаточно легко будет
проанализировать основное электронное состояние молекулы ![]() . Дело в том, что состояния электронов в
. Дело в том, что состояния электронов в ![]() можно представить в первом приближении как
одноэлектронные симметричные и антисимметричные состояния иона
можно представить в первом приближении как
одноэлектронные симметричные и антисимметричные состояния иона ![]() , так как электроны снова находятся в
электрическом поле двух протонов. Но если в
, так как электроны снова находятся в
электрическом поле двух протонов. Но если в ![]() эти
состояния занимались одним электроном, то теперь в каждом состоянии могут
находиться два. По этой причине необходимо принимать во внимание принцип Паули,
согласно которому двухэлектронная волновая функция с учетом спина электронов
должна быть антисимметричной.
эти
состояния занимались одним электроном, то теперь в каждом состоянии могут
находиться два. По этой причине необходимо принимать во внимание принцип Паули,
согласно которому двухэлектронная волновая функция с учетом спина электронов
должна быть антисимметричной.
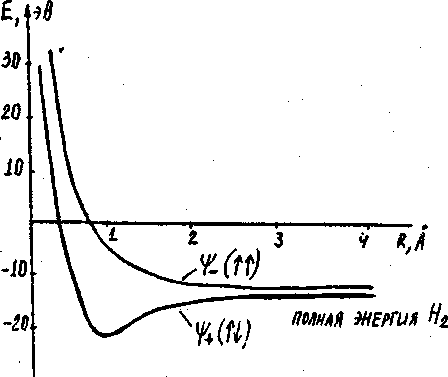
Так как рассмотренное связывающее состояние ![]() является симметричным по отношению к
перестановке пространственных координат, то чтобы двухэлектронная волновая
функция была антисимметричной, в таком состоянии должны находиться два
электрона с противоположными спинами. Наоборот, так как состояние
является симметричным по отношению к
перестановке пространственных координат, то чтобы двухэлектронная волновая
функция была антисимметричной, в таком состоянии должны находиться два
электрона с противоположными спинами. Наоборот, так как состояние ![]() является антисимметричным по отношению к
перестановке пространственных координат, то в этом состоянии электроны могут
иметь только параллельные спины. Образование и существование молекулы
является антисимметричным по отношению к
перестановке пространственных координат, то в этом состоянии электроны могут
иметь только параллельные спины. Образование и существование молекулы ![]() возможно лишь в первом состоянии, когда
спины двух электронов антипараллельны. Эта ситуация и соответствует
классической реализации ковалентной связи. В любых молекулярных соединениях,
где бы ни осуществлялась такая связь, она характеризуется одним важным
свойством – насыщением. Каждая отдельная связь всегда содержит не более двух
электронов, так как размещение большого количества запрещено принципом Паули.
возможно лишь в первом состоянии, когда
спины двух электронов антипараллельны. Эта ситуация и соответствует
классической реализации ковалентной связи. В любых молекулярных соединениях,
где бы ни осуществлялась такая связь, она характеризуется одним важным
свойством – насыщением. Каждая отдельная связь всегда содержит не более двух
электронов, так как размещение большого количества запрещено принципом Паули.
2. Ионная связь
Если ковалентная связь обязана происхождением своеобразному обобществлению пары электронов двух атомов, то в основе ионной связи лежит полная передача электрона от одного атома другому. Это образование должно быть энергетически выгодным для объединяющихся атомов.
Рассматривая многоэлектронные атомы, мы убедились в том, что для наиболее стабильных электронных конфигураций характерны полностью заполненные или замкнутые внешние оболочки. Поэтому при близком взаимодействии различных атомов для них может Оказаться более предпочтительной ситуация, когда они путем взаимного обмена либо отдают электроны с внешних незамкнутых оболочек, либо присоединяют к ним дополнительные электроны. Эти процессы приводят к тому, что внешние оболочки атомов оказываются замкнутыми, а сами атомы превращаются в положительные или отрицательные ионы, которые и образуют молекулу в результате электростатического притяжения друг к другу. Но такая связь возникает только в том случае, если полная энергия образующейся молекулы меньше, чем полная энергия исходных атомов. Как и в случае ковалентной связи, энергия системы должна понижаться.
В качестве примера реализации ионной связи рассмотрим молекулу КСl.
Конфигурация калия имеет вид 1s22s22p63s23p64s1.
Три первые оболочки у калия оказываются полностью укомплектованными электронами, а на внешней четвертой оболочке находится всего один электрон. Чтобы иметь полностью заполненную внешнюю оболочку, атому калия достаточно отдать этот электрон и превратиться в положительный ион К+. В этом случае внешней оболочкой станет третья.
Электронная конфигурация хлора имеет вид 1s22s22p63s23p5. Чтобы полностью заполнить внешнюю третью оболочку, атому хлора достаточно присоединить один электрон и превратиться в отрицательный ион Cl–.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.