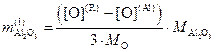 ,
(4.9)
,
(4.9)
где [O](R) – равновесное содержание кислорода с элементом, определяющим окисленность металла. До добавления алюминия;
![]() – молярные массы атомарного
кислорода и глинозёма.
– молярные массы атомарного
кислорода и глинозёма.
Подставляя [O](Si),
[O](Al),
MO,
![]() в (4.9) найдём массу (%)
первичных включений Al2O3
в (4.9) найдём массу (%)
первичных включений Al2O3
![]() .
.
При охлаждении
металла равновесное содержание кислорода будет снижаться, и избыток кислорода будет
выделяться в виде включений, которые принято называть вторичными. Константа
равновесия реакции (4.7) равна ![]() при
1550 °С. Зависимостью коэффициентов активности алюминия и кислорода от
температуры можно пренебречь, поскольку 1873/1823 = 1,027 ≈ 1. Тогда
равновесная с алюминием активность кислорода при 1550 °С равна
при
1550 °С. Зависимостью коэффициентов активности алюминия и кислорода от
температуры можно пренебречь, поскольку 1873/1823 = 1,027 ≈ 1. Тогда
равновесная с алюминием активность кислорода при 1550 °С равна
![]() .
.
Равновесное содержание кислорода
![]() .
.
Масса образовавшихся при охлаждении жидкого металла на 50 °С вторичных включений
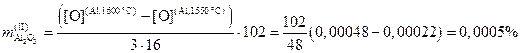 .
.
Таким образом, для варианта №0 при добавлении алюминия и его остаточном содержании на уровне 0,015% равновесное содержание кислорода составляет 4,8 ppm, а количество первичных и вторичных включений – 0,0136 и 0,0005 % масс. соответственно.
При одновременном раскислении несколькими раскислителями, например кремнием и алюминием, продуктами раскисления будут уже не чистые кремнезём (SiO2) или глинозём (Al2O3), а химические соединения, в соответствии с диаграммой состояния системы SiO2-Al2O3 (рис. 4.1). Глинозём и кремнезём образуют одно химическое соединение – муллит (3Al2O3·2SiO2), температура плавления которого составляет 1815 °С. Поэтому при 1600 °С продуктом комплексного раскисления стали кремнием и алюминием будет твердое соединение (3Al2O3·2SiO2).
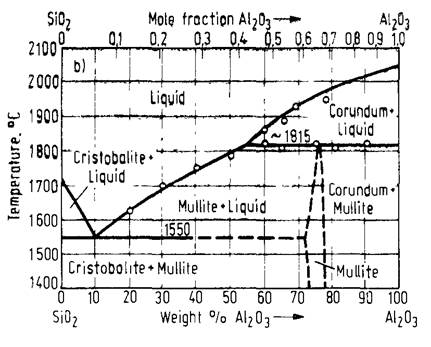
Рисунок 4.1 – Диаграмма состояния SiO2-Al2O3 [6]
Равновесную активность кислорода в этом случае можно найти по реакциям
![]() (4.4)
(4.4)
![]() (4.7)
(4.7)
![]() . (4.10)
. (4.10)
Суммируя (4.4), (4.7) и (4.10), получаем
![]() (4.11)
(4.11)
![]() .
.
Константа равновесия реакции (4.11)
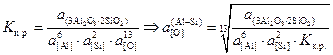 .
(4.12)
.
(4.12)
Поскольку
образуется чистое твердое соединение, то ![]() . При 1600 °С константа
равновесия равна
. При 1600 °С константа
равновесия равна ![]() . Для
состава жидкой стали варианта №0 ранее подсчитано
. Для
состава жидкой стали варианта №0 ранее подсчитано ![]() и
и ![]() . Подставляя в (4.12)
получаем
. Подставляя в (4.12)
получаем
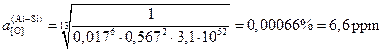
![]() .
.
Таким образом, при раскислении жидкой стали одновременно кремнием и алюминием состава варианта №0 ([Al = 0,015%, [Si] = 0,45%) равновесное содержание кислорода составит 9,9 ppm, что примерно в два раза выше, чем при раскислении одним алюминием. Отметим, что совместное раскисление может сопровождаться образованием растворов оксидов, например, при раскисления кремнием и марганцем. В этом случае, происходит взаимное разбавление оксидов, их активности становятся меньше единицы и активность кислорода в металле снижается.
Удаление серы в восстановительный период происходит за счёт перераспределения её между металлом и шлаком. Важнейшим параметром процесса десульфурации является коэффициент распределения серы (LS) между металлом и шлаком
![]() ,
(4.13)
,
(4.13)
где (S), [S] – массовая доля серы (%) в шлаке и металле соответственно.
Чем больше коэффициента распределения, тем большее количество серы может перейти в шлак. Для расчета LS можно использовать полуэмпирическое выражение
![]() , (4.14)
, (4.14)
где (%МеО) – массовая доля соответствующего оксида в шлаке, %;
a[O] – активность кислорода в металле;
fS – коэффициента активности серы в жидкой стали.
Как видно из (4.14) удалению серы способствует высокая основность шлака (в данном случае отношение (%CaO+%MgO) к (%SiO2+%Al2O3)), высокий коэффициент активности серы в жидкой стали и низкая окисленность металла (восстановительные условия). Зная значение коэффициента распределения серы, конечное её содержание в жидкой стали можно рассчитать исходя из системы уравнений
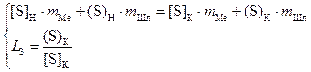 ,
(4.15)
,
(4.15)
где mMe, mШл – массы металла и шлака соответственно;
[S]H, [S]K, (S)H, (S)K – начальные и конечные содержания серы в металле и шлаке, %.
Аналогично выводу конечного содержания фосфора в домашнем задании №1, для конечного содержания серы в металле получаем
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.