![]()
![]()
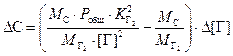
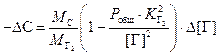 .
(3.6)
.
(3.6)
Поскольку при
удалении газов парциальное давление ![]() ,
то формулу (3.6) нельзя использовать напрямую для расчета конечной концентрации
растворённого газа при окислении заданного количества углерода (∆С). Для
получения корректного уравнения необходимо в (3.6) разности ∆С и ∆[Г] заменить
на дифференциалы dС и d[Г],
и провести интегрирование уравнения (3.6) от начальных содержаний (СН,
[Г]Н) до конечных (СК, [Г]К).
,
то формулу (3.6) нельзя использовать напрямую для расчета конечной концентрации
растворённого газа при окислении заданного количества углерода (∆С). Для
получения корректного уравнения необходимо в (3.6) разности ∆С и ∆[Г] заменить
на дифференциалы dС и d[Г],
и провести интегрирование уравнения (3.6) от начальных содержаний (СН,
[Г]Н) до конечных (СК, [Г]К).
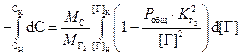
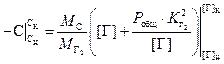
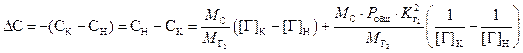 . (3.7)
. (3.7)
Расчёты удаления
азота и водорода по формуле (3.7) показывают, что вклад слагаемого ![]() не превышает 2% отн.
Поэтому (3.7) удобно переписать в виде
не превышает 2% отн.
Поэтому (3.7) удобно переписать в виде
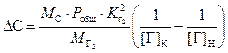 .
(3.6)
.
(3.6)
Уравнение (3.6) принято называть формулой Геллера, которая количественно описывает удаление растворённых в жидкой стали газов с пузырьками СО при проведении окислительного рафинирования металла.
Преобразовав (3.6), получаем формулу Геллера для расчета текущей равновесной концентрации азота при обезуглероживании
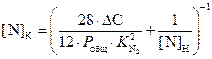 . (3.7)
. (3.7)
Формула Геллера для расчета текущей равновесной концентрации водорода при обезуглероживании
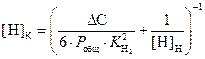 .
(3.8)
.
(3.8)
При обезуглероживании в открытой печи можно принять, что Робщ = 1 атм. Реакция растворения азота в жидком железе имеет вид
![]() .
(3.9)
.
(3.9)
Константа
равновесия реакции (3.9) (см. приложение Е) при 1600 °С ![]() , начальное содержание азота
[N]H
= 0,016% для варианта №0. На рисунке 3.1 представлена зависимость содержания
азота от количества окисленного углерода при продувке жидкого железоуглеродистого
полупродукта кислородом.
, начальное содержание азота
[N]H
= 0,016% для варианта №0. На рисунке 3.1 представлена зависимость содержания
азота от количества окисленного углерода при продувке жидкого железоуглеродистого
полупродукта кислородом.
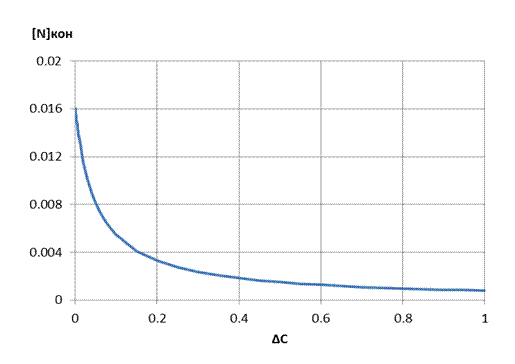
Рисунок 3.1 – Зависимость концентрации азота от количества окисленного углерода
Реакция растворения водорода в жидком железе имеет вид
![]() .
(3.10)
.
(3.10)
Для водорода при 1600
°С ![]() (см. приложение Е),
начальное содержание [Н]H =
0,0016% для варианта №0. На рисунке 3.2 представлена зависимость
содержания водорода от количества окисленного углерода при продувке жидкого
полупродукта кислородом.
(см. приложение Е),
начальное содержание [Н]H =
0,0016% для варианта №0. На рисунке 3.2 представлена зависимость
содержания водорода от количества окисленного углерода при продувке жидкого
полупродукта кислородом.
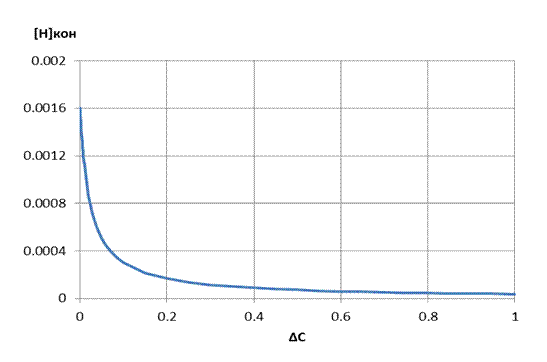
Рисунок 3.2 – Зависимость концентрации водорода от количества окисленного углерода
Для определения количества углерода, необходимого для получения заданного содержания азота ([N]К = 0,004%), перепишем уравнение (3.6) применительно к удалению азота
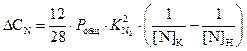 .
(3.11)
.
(3.11)
Для варианта №0
![]() .
.
Для определения количества углерода, необходимого для получения заданного содержания водорода ([Н]К = 0,0002%), запишем уравнение (3.6) для случая рафинирования расплава от водорода
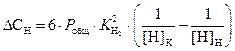 .
(3.12)
.
(3.12)
Для варианта №0
![]() .
.
Равновесное с газовой фазой содержание азота можно рассчитать, рассмотрев выражение для константы равновесия реакции (3.9)
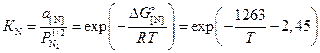 .
(3.13)
.
(3.13)
С учётом выражения для активности азота a[N] = [N]·fN получаем
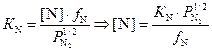 .
(3.14)
.
(3.14)
Для заданного состава газовой фазы (N2 = 78% об.) парциальное давление азота
![]() .
.
где ![]() – мольная доля азота в виде
N2
в газовой фазе.
– мольная доля азота в виде
N2
в газовой фазе.
Коэффициент активности азота можно найти по составу жидкой стали с использованием массовых параметров взаимодействия с учётом температурной зависимости, предложенной Чипманом и Корриганом (John Chipman, D.A. Corrigan) и отвечающей модели квазирегулярных растворов:
![]() ,
(3.15)
,
(3.15)
где k – число компонентов жидкой стали.
Для состава стали варианта
№0 при 1873 К из приложения 5: ![]() ,
,
![]() и
и ![]() .
.
![]()
![]() .
.
Отсюда равновесное с газовой фазой (N2 78% об.) содержание азота в жидкой стали состава варианта №0 по уравнению (3.14)
![]() .
.
Отметим, что фактические содержания азота в стали ниже полученного значения и составляют обычно от 0,008…0,020%. Это несоответствие вызвано наличие защитного шлакового слоя на поверхности жидкого металла.
Равновесное с газовой фазой содержание водорода можно рассчитать, рассмотрев константу равновесия реакции (3.10)
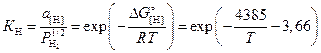 .
(3.16)
.
(3.16)
С учётом выражения для активности водорода a[Н] = [Н]·fН получаем
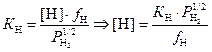 .
(3.17)
.
(3.17)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.