Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
1.1.. Реакция, протекающая по схеме:
![]() 2 KCl + 3O2
2 KCl + 3O2
6KClO3 →3 KClO4 + KCl, классифицируется как а) последовательная; б) параллельная; в) сопряженная; г) цепная; д) обратимая.
1.2.Мономолекулярной является реакция:
а) 2А®С; б) 2А®С+Д; в) А®С+Д;
г) А+В®С; д) А+В®2С.
1.3. Средняя скорость образования продукта реакции Д выражается как:
а)![]()
б) ![]()
в)![]() ,
,
г) ![]() ,
,
д) ![]()
1.4. Зависимость константы скорости химической реакции от температуры описывает уравнение:
а) Вант-Гоффа; б) Ле Шателье;
в) Аррениуса;
г) Гульдберга и Вааге;
1.5. Кинетическое уравнение реакции 0-го порядка в дифференциальной и интегральной формах:
а)![]()
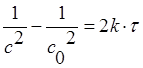 ; б)
; б)
![]()
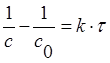 ;
;
в) ![]()
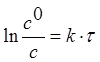 ; г)
; г)
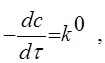
![]() ;
;
![]() ,
,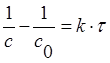
1.6. Единицы измерения константы скорости реакции нулевого порядка: а) с-1; б) дм3/(моль·с);
в) моль/(дм3·с);
г) дм6/(моль2·с); д) 1/(моль·дм3·с)
1.7.Зависимость скорости химической реакции от концентрации реагентов описывает закон:
а) Вант-Гоффа;
б) Аррениуса; в) Ле Шателье;
г) Гульдберга и Вааге; д) Гиббса.
1.8.Зависимость скорости химической реакции от температуры описывает уравнение Аррениуса:
а)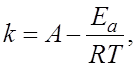 б)
б)![]() в)
в)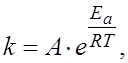
г) 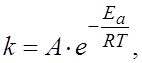 д)
д) ![]()
9.1. При условии, что реакция Cграфит + О2(г) Û СО2(г) является простой, её скорость описывается в соответствии с законом действия масс уравнением:
а) ![]() б)
б)
![]() в)
в)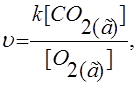 г)
г)![]() д) υ=k
д) υ=k
1.10. Графически, зависимость ![]() для
реакции нулевого порядка выглядит как:
для
реакции нулевого порядка выглядит как:
![]()
![]()
![]()
![]() а) υ б) υ
в) υ г) υ
а) υ б) υ
в) υ г) υ
 |
|||||||
 |
|||||||
 |
|||||||
![]()
![]()
![]()
![]() C
C C C
C
C C C
Д)υ ![]()
C
1.11.Правило Вант-Гоффа описывает соотношение:
а)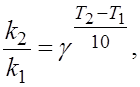
б)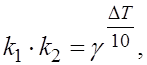
в)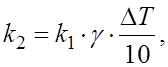
г) 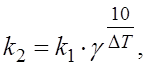
д) 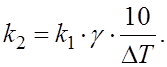
1.12.Константа скорости химической реакции не зависит от: а) температуры; б) концентрации; в) катализатора; г) природы реагирующих веществ; д) энергии активации.
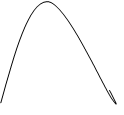
1.13. Изменение концентрации реагентов во времени для необратимой простой реакции А®В выражает графическая зависимость:
![]()
![]() С С
С С
С С
С С

![]()



![]()
![]() а) А
б) А в) А г) А
а) А
б) А в) А г) А
![]() В
В
![]()
![]()
![]()
![]() В0 t В0 t1/2 t В0
t 0 t
В0 t В0 t1/2 t В0
t 0 t
![]() д)с
д)с
А
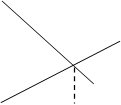
![]() В0 t1/2 t
В0 t1/2 t
1.14. Концентрация активированного комплекса [А....В] реакции А+В®С+Д связана с концентрациями
реагентов соотношением: а)[A….B] =с(A) · с(B), б)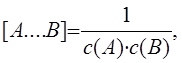 в)[A…B] = K#
с(A) · с(B), г)
в)[A…B] = K#
с(A) · с(B), г)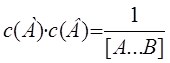 , д) [A….B] = k· с(A) · с(B)
, д) [A….B] = k· с(A) · с(B)
1.15.Для реакций ферментативного катализа характерен тип:
а) последовательных многостадийных; б) параллельных многостадийных;
в) сопряженных многостадийных реакций;
г) конкурирующих;
д) цепных реакций.
1.16.Форма кинетической кривой, описывающей ферментативный катализ в координатах: концентрация субстрата - время имеет характер:
а) прямой, восходящей от начала координат; б) прямой, параллельной оси абсцисс;
в) прямой, параллельно оси ординат; г) S - образной кривой с переходным, стационарным и основным участием; д) кривой с восходящим, стационарным и нисходящим участками
1.17.Практически все процессы метаболизма протекают как сложные реакции:
а) параллельные (конкурирующие);
б) сопряженные;
в) последовательные;
г) цепные;
д) разветвленные.
1.18. Константа химического равновесия Kc определяется: а) отношением скоростей прямой и обратной реакций;
б) отношением констант скорости прямой и обратной реакций;
в) площадью соприкосновения фаз в гетерогенном процессе;
г) наличием катализатора в системе; д) скоростью отвода продуктов реакции.
1.19. Самой слабой кислотой в водном растворе будет электролит с Ka:
а) Ka (HNO2) = 4 ·10-4, б) Ka(глутаминовая кислота) = 4,7· 10-5, в) Ka (аскорбиновая кислота)= 9,1· 10-5, г) Ka(СН3СООН) = 1,74· 10-5, д) Ka(CHCl2COOH) = 5,0 · 10-2.
1.20. Наиболее прочным в водном растворе будет комплексное соединение с константой нестойкости Кн:
а)K[AgCl], Кн=5,8 · 10-8; б) K[AuCl2], Кн=1,0 · 10-27;
в) K[CdCl6], Кн=2,7 · 10-5;
г) K[CoCl6], Кн=4,0 · 10-5;
д) K[CuCl2], Кн=1,2 · 10-9
Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
2.1.Реакция, протекающая по схеме:
C18H32O16 + H2O® C12H22O11 + C6H12O6 +H2O® 3C6H12O6
классифицируется как а) последовательная; б) параллельная; в) сопряженная; г) цепная; д) обратимая.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.