в) действия катализаторов; г) стехиометрической концентрации реагентов; д) внешнего давления.
6.6. Константа скорости реакций определяет зависимость:
а) скорости от концентрации исходных веществ; б) скорости от концентрации продуктов реакции;
в) скорости от природы реагирующих веществ, концентрации и температуры;
г) скорости от природы реагирующих веществ, температуры и других внешних условий; д) скорости химической реакции от внешних условий.
6.7.Состояние системы с ослабленными старыми связями исходных веществ и наметившимися новыми называют:
а) энергетическим барьером; б) активированным комплексом;
в) зарождением цепи; г) образованием активных молекул; д) обрывом цепи.
6.8. Разложение вещества А протекает по двум следующим параллельным стадиям:
k1 k2
А ® В А ® С ,наибольшая
энергия активации этих реакций, если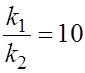 при 10°С
составляет величину для реакции а)2,203 кДж; А®С;
при 10°С
составляет величину для реакции а)2,203 кДж; А®С;
б) 10,5 кДж; А ®В ; в) 10,5 кДж; А ®С; г) 5,417 кДж; А® В;
д) 5,417 кДж; А ®С.
6.9.Скорость химической реакции
CaCO3(т) + 2HCl(в) ® CaCl2(в) + H2O(ж) + CO2(г)
в соответствии с законом действия масс можно выразить уравнением:
а)![]()
б) ![]()
в) ![]()
г) 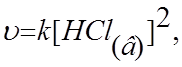
д) 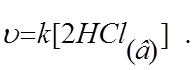
6.10.График
зависимости ![]() для ферментативной реакции:
для ферментативной реакции:
a) ![]()
![]()
![]()
![]() υ
б) υ в) υ г) υ
υ
б) υ в) υ г) υ
 |
|||||||
 |
|||||||
 |
|||||||
 |
|||||||
![]()
![]()
![]()
![]() 0 τ 0
τ 0 τ 0
0 τ 0
τ 0 τ 0 ![]() τ
τ
д)υ ![]()
0 τ
6.11. Скорость реакции при увеличении температуры на 20 градусов возросла в 16 раз, следовательно температурный коэффициент равен:
а) 8; б) 4; в) 2; г) 3,2; д)1,25.
6.12. В кинетическое уравнение скорости гетерогенной химической реакции влияние поверхности раздела фаз входит в величину:
а) константы скорости; б) количества вещества реагента, находящегося в твердой фазе; в) энергии активации; г) предэкспоненциального множителя; д) степенного фактора.
6.13. Повышение температуры
человеческого тела до 315 к (42°С) приводит к увеличению
скорости биохимических превращений при ![]() =
10 кДж/моль на:
=
10 кДж/моль на:
а) 10%; б) 90%; в) 6%; г) 60%; д) 40%.
6.14. Теория активированного комплекса позволяет а) вывести закон действующих масс для простых реакций: А + В ® С + Д
б) определить энергию активации в) определить число активных столкновений г) выявить физический смысл предэкспоненты А,
д) использовать закон Максвелла-Больцмана в химической кинетике
6.15. Вещества, замедляющие химические реакции называются: а) промоторами; б) ингибиторами; в) катализаторами; г) сопряженными; д) конкурирующими.
6.16. Константа Михаэлиса Км численно равна такой концентрации субстрата Сs, при которой выполняется соотношение:
а) сs >>Км, б) сs << Км,
в)
![]()
г)
υст =υmax, д)

6.17. Использование фермента каталазы уменьшает энергию активации разложения пероксида водорода, примерно а) в 100 раз; б)до 25,0 кДж/моль; в) в 5 раз; г) в 300 раз; д) в 10 раз.
6.18. Как изменяется величина константы Kc с увеличением температуры в экзотермическом процессе:
а) увеличивается линейно; б) уменьшается линейно;
в) остается без изменений, т.к. температура не оказывает влияние на Kc.;
г) увеличивается по экспоненциально; д) уменьшается по экспоненциально.
6.19.Наибольшая концентрация ионов водорода в чистой воде будет содержаться при температуре t0C и ионном произведении воды Kw:
а) Kw 50C=1,8 · 10-15, б) Kw 180C=5,7 · 10-15, в) Kw 250C=1,0 · 10-14, г) Kw 400C=2,9 · 10-14, д) Kw 650C=1,2 · 10-13
6.20. Наименьшую концентрацию простых ионов в водном растворе образует комплексное соединение с константой устойчивости Ку:
а) Ку[Ag(NH3)2] = 2,089 ·103, б) Ку([Cu(NH3)4]2+) = 9,772 ·103, в) Ку([Hg(NH3)4]2+) = 6,3095 ·108,
г) Ку([Mn(NH3)6]2+) = 6,309, д) Ку([Zn(NH3)4]2+) = 1,51 ·102
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.