б) сопряженными;
в) параллельными;
г) последовательными;
д) обратимыми.
3.15.Каталитические реакции, протекающие на твердом катализаторе называют:
а) обратимыми; б) последовательными; в) параллельными; г) гомогенными; д) гетерогенными.
3.16.Уравнение Михаэлиса-Ментен (1913) для ферментативного катализа устанавливает зависимость:
а) стационарной скорости реакции от концентрации субстрата; б) скорости реакции от концентрации или активной поверхности катализатора;
в) изменение скорости в присутствии катализатора;
г) изменение энергии активации реакции под влиянием катализатора;
д) скорости реакции от состава фермент-субстратного комплекса.
3.17. Теория активированного комплекса вводит понятие энтальпии активации ΔH#и устанавливает равенство:
а) ΔG#=ΔH# -TΔS#;
б) ΔH# =Ea;
в) υ = K’K# c(A)(B);
г) A=k’eΔS#/R ;
д) k=k’K# .
3.18. Величина константы равновесия определяет:
а) полноту протекания реакции; б) величину энергии активации; в) скорость прямой реакции;
г) влияние температуры на химический процесс; д) влияние давления.
3.19.Максимальная концентрация ионов Са2+ в насыщенном растворе трудно растворимого электролита будет при значении ПР:
а)ПР(CaCO3) = 3,8 ·10-9, б) ПР(CaCrO4) = 2,3 ·10-9, в)ПР(CaCrO4) = 7,1 ·10-4, г) ПР(CaF2) = 4,0 ·10-11, д) ПР(CaSO4) = 2,5 ·10-5.
3.20. Самым слабым электролитом является электролит с константой ионизации Ka:
а) Ka(HNO3) = 4,0 ·10-4, б) Ka(HN3) = 2,6 · 10-5, в) Ka(HBrO) = 2,0· 10-9, г) Ka(H2O2) = 2,0 · 10-12,
д) Ka(H2S) = 6,0· 10-8
Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
4.1. Реакция, протекающая по схеме:
![]() Cl* + H-H ® HCl
+ H*
Cl* + H-H ® HCl
+ H*
![]() H2 + Cl2
® Н2 +
2Cl*® HCl
+ H*
H2 + Cl2
® Н2 +
2Cl*® HCl
+ H*
H* + Cl-Cl ® HCl + Cl*, классифицируется как а) последовательная; б) параллельная; в) сопряженная; г) цепная; д) обратимая.
4.2.Реакция H2(г) + I2(г) Û 2HI(г) по кинетическому уравнению является реакцией: а) υ = kc первого порядка; б) υ = kc2 второго порядка;
в) υ = kc3 третьего порядка; г) мономолекулярной; д) тетрамолекулярной.
4.3.Мгновенную (истинную) скорость реакции разложения исходного вещества А описывает соотношение:
а) ![]() б)
б) ![]() в)
в) ![]() г)
г) ![]() , д)
, д) ![]()
4.4. Скорость химической реакции изменяется в 2-4 раза при изменении температуры:
а) в 2-4 раза; б) на каждые десять градусов;
в) на 50 градусов; г) от стандартной до ста градусов; д) в сторону увеличения.
4.5. Кинетическое уравнение реакции 3го порядка в дифференциальной и интегральной формах:
а) ![]()
![]() ;
;
б) ![]()
![]() ;
;
в) ![]()
![]() ;
;
г) ![]()
![]() ;
;
д) ![]()
![]()
4.6. Единицы измерения константы скорости реакции третьего порядка: а) с-1; б) дм3/(моль · с); в) дм6/(моль2 ·с); г) моль· дм3 · с-1; д) моль-1 ·с-1 ·дм-3
4.7.Механизм химического взаимодействия раскрывает теория:
а) Аррениуса; б) активных столкновений; в) Вант-Гоффа; г) подвижного равновесия; д) Гиббса
4.8.Зависимость скорости химической реакции от величины энергии активации описывает уравнение Аррениуса:
а)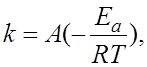
б)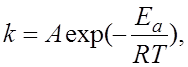
в) 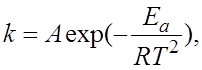
г)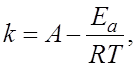
д)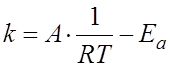
4.9. При условии, что прямая реакция Mg(т)+ 2HCl(в) Û MgCl2(в) + H2(г)
имеет простой механизм,
выражение её скорости в соответствии с законом действия масс: а)![]() б)
б) 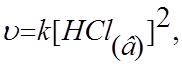
![]()
в)![]() г)
г) ![]()
д) 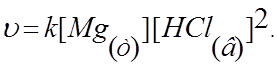
4.10. Предэкспоненциальный множитель А в уравнении Аррениуса
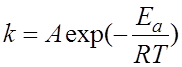 может быть найден графически
по зависимости:
может быть найден графически
по зависимости:
![]() а)
а)
![]()
![]()
![]() ln k б) ln k в) ln k г) ln k
ln k б) ln k в) ln k г) ln k

![]() a
a
![]()
 a
a
а
![]()
![]()
![]()
![]() 0 A=0a
1/T 0 A=0a 1/T 0 A=0в в 1/T 0 A=0a 1/T
0 A=0a
1/T 0 A=0a 1/T 0 A=0в в 1/T 0 A=0a 1/T
 д)
ln k
д)
ln k ![]()
a
![]() 0
0
A=0a 1/Т
4.11.Скорость химической реакции при температурном коэффициенте, равном двум и увеличении температуры на 50 градусов возрастет:
а) в 50 раз; б) в 2 раза; в) в 32 раза; г) в 8 раз; д) в 100раз
4.12. Скорость химической реакции линейно зависит от времени
в координатах![]() для реакции:
для реакции:
а) нулевого порядка; б) первого порядка; в) второго порядка; г) третьего порядка; д) сложной, обратимой.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.