в) температуры процесса; г) присутствия катализатора; д) присутствия ингибирующих веществ.
2.19. Концентрация ионов Zn2+ будет максимальной в водном растворе с константой нестойкости Kн:
а)Кн[ZnBr]+ =4,0,
б) Кн[ZnCl]+=15,4,
в) Кн[ZnJ4]2-=220,
г) Кн[Zn(NH3)2]2+ =4,8 · 10-8,
д) Кн[Zn(ЭДТА)]2+ =3,2 · 10-17
2.20. Концентрация ионов OH- будет максимальной в насыщенном растворе малорастворимого гидроксида с произведением растворимости ПР:
а) ПР(Ni(OH)2)=2,0 · 10-15,
б) ПР(Pb(OH)2)=5,0 · 10-16,
в) ПР(Cu(OH)2)=2,2 · 10-20, г) ПР(Co(OH)2)=1,6 · 10-15,
д) ПР(Ca(OH)2)=5,5 · 10-6
Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
![]() 3.1. Реакция,
протекающая по схеме:
3.1. Реакция,
протекающая по схеме:
CH3COOH + C2H5OH Û CH3COOC2H5 + H2O, классифицируется как а) последовательная; б) параллельная; в) сопряженная; г) цепная; д) обратимая.
3.2.Тримолекулярной является реакция:
а) 2А®С;
б) А+В®С;
в) А+В+С®Д;
г) А®В+С+Д;
д) А+В®С+Д+Е.
3.3.Изменение концентрации вещества в единицу времени называется:
а) молекулярностью реакций; б) порядком реакций;
в) скоростью химических реакций; г) элементарным актом реакций;
д) кинетическим уравнением химической реакции.
3.4.Константа скорости химической реакции зависит от температуры:
а) прямо пропорционально;
б) экспоненциально;
в) обратнопропорционально; г) по уравнению Максвелла-Больцмана; д) по уравнению Менделеева-Клапейрона.
3.5. Кинетическое уравнение реакции 2го порядка в дифференциальной и интегральной формах:
а) ![]()
![]() ; б)
; б) ![]()
![]() ;
;
в) ![]()
![]() ; г)
; г) ![]()
![]() ;
;
д) ) ![]()
![]()
3.6. Единицы измерения константы скорости реакции второго порядка: а) с-1;
б) дм3/(моль с);
в) дм6/(моль2·с);
г) моль/(дм3·с);
д) моль-1·с-1·дм-3
3.7.Зависимость скорости химической реакции от концентрации реагентов описывает закон:
а) химического сродства; б) действия масс; в) Максвелла-Больцмана; г) Эйринга-Поляни;
д) Вант-Гоффа.
3.8.Энергия активации химических реакций, протекающих при комнатной температуре не должна превышать:
а)200 Дж/моль;
б)200 кДж/моль;
в) 150 Дж/моль;
г) 150 кДж/моль;
д) 500 кДж/моль
3.9. Реакция в газовой фазе А+В®С имеет второй порядок по веществу А и нулевой порядок по веществу В. Выражение скорости в соответствии с законом действия масс:
а)![]()
б)![]()
в)![]()
г)![]()
д)![]()
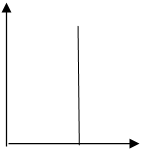
3.10. Графически, зависимость ![]() для
реакции второго порядка 2А®В выглядит как:
для
реакции второго порядка 2А®В выглядит как:
а) ![]()
![]()
![]()
![]() υ
б) υ в) υ г) υ
υ
б) υ в) υ г) υ
 |
|||||||
 |
|||||||
 |
|||||||
![]()
![]()
![]()
![]() C
C C C
C
C C C
д)υ
С
3.11.Температурный коэффициент равен трем. При повышении температуры на 10 градусов скорость химической реакции возрастет:
а) в 9 раз;
б) в 3 раза;
в) в 10 раз;
г) в 3,3 раза;
д) в 30 раз.
3.12.Скорость
химической реакции линейно зависит от времени в координатах ![]() для реакции:
для реакции:
а) нулевого порядка; б) первого порядка; в) второго порядка; г) третьего порядка;
д) сложной, обратимой.
3.13.Фармакокинетика введения и выведения препарата из организма выражается графически (где m0, мг- начальная доза препарата):
![]()
![]()
![]()
![]() m мг m
мг m мг
m мг
m мг m
мг m мг
m мг

![]()

![]()
 а) m0
б) в) m0 г) m0
а) m0
б) в) m0 г) m0

![]() m0
m0
![]()
![]()
![]()
![]() m0/2 m0/2 m0/2
m0/2 m0/2 m0/2
![]()
![]()
![]()
![]() m0/2
m0/2
![]()
![]()
![]()
![]() 0 t1/2 t 0 t1/2 t 0 t1/2 t 0 t1/2 t
0 t1/2 t 0 t1/2 t 0 t1/2 t 0 t1/2 t
![]() д)
m мг
д)
m мг
![]()
![]()
![]()
![]() 2m0
2m0
m0
![]() t1/2 t
t1/2 t
3.14. Окисление глюкозы в организме и сопутствующий процесс синтеза АТФ из АДФ и фосфата являются а) конкурирующими;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.