![]() j
j
![]()
![]()
![]()
![]() 0 Еа= 0a ·R 1/T 0 Ea= 0в ·R 1/T 0 Ea= tg j ·R 1/T 0 Ea=
tg j ·1/R 1/T
0 Еа= 0a ·R 1/T 0 Ea= 0в ·R 1/T 0 Ea= tg j ·R 1/T 0 Ea=
tg j ·1/R 1/T
д) ln
k ![]()
 a
a
j
![]()
![]() 0
0
Еа= 0a ·R 1/Т
5.11.Сколько секунд будет длиться химический процесс при понижении температуры на 50 градусов, если при начальной температуре он длился 160 с, а температурный коэффициент равен двум:
а) 32 с; б) 5 с; в) 1,6 с; г) 16 с; д) 0,03125 с.
5.12. Скорость химической
реакции линейно зависит от времени в координатах ![]() для
реакции:
для
реакции:
а) нулевого порядка; б) первого порядка; в) второго порядка; г) третьего порядка; д) сложной, обратимой.
5.13.
Значение температурного коэффициента g в области ![]() нормальной температуры
жизнедеятельности человеческого организма зависит от энергии активации-
нормальной температуры
жизнедеятельности человеческого организма зависит от энергии активации- ![]() в области 10-100 кДж/моль
следующим образом: а)
в области 10-100 кДж/моль
следующим образом: а)![]()
б) ![]()
в)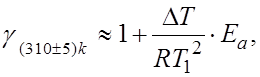
г) 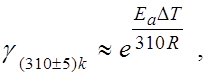
д) 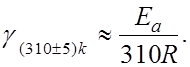
5.14. При возрастании температуры число активных столкновений, приводящих к химическому взаимодействию, изменяется:
а) возрастает линейно;
б) возрастает по логарифмическому закону;
в) обратнопропорционально росту температуры;
г) уменьшается экспоненциально; д) возрастает экспоненциально.
5.15.Активностью катализатора Вк называется относительное ускорение реакции под влиянием катализатора,следовательно, активность катализатора:
а) Вк = kк, где kк - константа скорости каталитической реакции;
б)Вк= Dk, где Dk - увеличение константы скорости под действием катализатора;
в) Вк= DV, где DV - изменение скорости под влиянием катализатора;
г)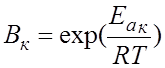 ,
где
,
где ![]() - энергия активации в
присутствии катализатора; д)
- энергия активации в
присутствии катализатора; д) 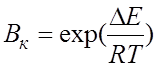 , где D
, где D![]() - уменьшение энергии
активации в присутствии катализатора.
- уменьшение энергии
активации в присутствии катализатора.
5.16. В биохимической реакции разложения пероксида водорода в клетке участвует катализатор - фермент, содержащий ионы Fe(II):
а) формиатдегидрогеназа; б)фосфоглюкомутаза; в)каталаза; г)карбоксипептидаза;
д)супероксиддисмутаза.
5.17.Уменьшение энергии активации в присутствии катализатора на
6 кДж/моль приведет к возрастанию скорости реакции примерно:
а) в 6 раз; б) в 10 раз; в) в 50 раз; г) возрастет в 100 раз; д) в 20 раз.
5.18. Величина константы Kc с увеличением температуры в эндотермическом процессе изменяется:
а) увеличивается линейно; б) уменьшается линейно;
в) остается без изменений, т.к. температура не оказывает влияние на Kc; г) увеличивается по экспоненциальному закону;
д) уменьшается по экспоненциальному закону.
5.19. При сливании равных объемов растворов нитрата свинца и соли натрия равных концентраций, наибольшее количество осадка образуется с ПР:
а) Pb(NO3)2+Na2CO3®ПР(PbCO3) = 7,5 · 10-14; б) Pb(NO3)2+Na2C2O4®ПР(PbC2O4) = 4,8 · 10-10;
в) Pb(NO3)2+NaCl®ПР (PbCl2) = 1,6 · 10-5 ; г) Pb(NO3)2+NaF ® ПР (PbF2) = 2,7 · 10-8;
д) Pb(NO3)2+NaJ ® ПР (PbJ2) = 1,1 · 10-9.
5.20. Наиболее сильным основанием будет вести себя в водном растворе при равных исходных концентрациях 0,1 моль/дм3:
а)Кв(NH3 · H2O) = 1,76 ·10-5, б) Кв(пурин) = 2,45 ·10-12, в) Кв(Са(ОН)2) = 4,0 ·10-2, г) Кв(анилин) = 4,3 ·10-10, д) Кв(мочевина) = 1,5 ·10-14
Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
6.1. Реакция, протекающая по схеме:
1) А1 + А2 ® В1 + В2
2) Х ® Y (в этом превращении участвует один из компонентов 1-й реакции)
классифицируется как а) последовательная; б) параллельная; в) цепная; г) сопряженная; д) обратимая
6.2.Реакция А + В ® С имеет суммарный порядок:
а) второй; б) третий; в) первый; г) бимолекулярный; д) тримолекулярный.
6.3.Среднюю
скорость реакций образования продукта Д определяет соотношение: а)![]() ,
б)
,
б) 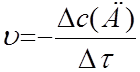 , в)
, в) 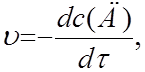
г) 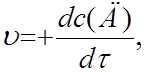 д)
д) 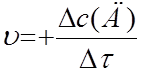
6.4. При понижении температуры на 10 градусов скорость уменьшается в 3 раза; следовательно, при понижении температуры от 80 до 50°С скорость реакции уменьшится:
а) в 15 раз; б) в 27 раз; в) в 243 раза; г) в 9 раз; д) в 45 раз.
6.5.Кинетическое уравнение химической реакции отражает зависимость скорости от: а) температуры; б) механизма взаимодействия;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.