4.13. Соотношение температурного коэффициента g и энергии активации - ![]()
![]() выражает уравнение:
выражает уравнение:
а)![]()
б) 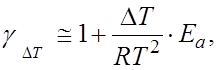
в)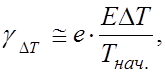
г)![]()
д) ![]()
4.14. Энергия активации ![]() связана
с термодинамическими функциями процесса активации:
связана
с термодинамическими функциями процесса активации:
а)![]() б)
б) ![]() в)
в) ![]()
г) д)
д)![]()
4.15.В биохимической реакции разложения пероксида водорода в клетке участвует катализатор - фермент, содержащий ионы Fe(II).
а) формиатдегидрогеназа; б)фосфоглюкомутаза; в)каталаза; г)карбоксипептидаза;
д)супероксиддисмутаза.
4.16. Уравнение Михаэлиса-Ментен при малых концентрациях субстрата сs, когда сs << Км. принимает вид:
а) ![]() б) υст =υmax, в)
б) υст =υmax, в)![]() г)
г)![]() д)
д) ![]()
4.17.
Время полупревращения τ1/2 для реакции нулевого порядка определяется
как а) ![]() ; б)
; б) ![]() ; в)
; в) ![]() ; г)
; г) ![]() ; д)
; д) ![]() .
.
4.18. Величина константы равновесия определяется:
а) соотношением энергий активаций химической реакции при разных температурах;
б) соотношением исходных концентраций реагирующих веществ;
в) соотношением равновесных концентраций;
г) соотношением конечных и исходных концентраций реагентов;
д) давлением в системе.
4.19. Самым слабым основанием в водном растворе будет:
а) a-аланин; Кн=2,2· 10-12; б)о-аминофенол; ; Кн=5,2· 10-10; в)валин; Кн=1,9· 10-12; г) лизин; Кн=8,9 · 10-6; д)ацетамид; Кн=3,0 · 10-14.
4.20. Наименьшую растворимость в водном растворе будет проявлять осадок с произведением растворимости:
а)ПР(AgCl) = 1,78 ·10-10;
б)ПР(AgBr) = 5,3·1013; в)ПР(AgJ) = 8,3 ·10-17, г) ПР(AgCN)=1,4 ·10- 16, д) ПР(Ag3PO4) = 1,3 ·10-20
Рубежный тест: Химическая кинетика. Катализ
Для студентов специальностей стоматология, лечебное дело, педиатрия
5.1. Реакция, протекающая по схеме
C6H6 + 2H2O2 + Fe2+ ® FeОOH2+ + H2O + C6H5OH, классифицируется как а) последовательная; б) параллельная; в) сопряженная; г) цепная; д) обратимая.
5.2.Реакция Cl2(г) + H2O(ж) ®HCl(в) + HClO(в) является реакцией:
а) мономолекулярной; б) второго порядка; в) первого порядка; г) третьего порядка; д) тетрамолекулярной.
5.3.Число частиц, участвующих в элементарном акте реакций называется:
а) молекулярностью химической реакции; б) порядком химической реакции;
в) скоростью химической реакции; г) механизмом химической реакции;
д) типом химической реакции.
5.4.Скорость химической реакции изменяется при увеличении температуры на 50 градусов и температурном коэффициенте, равном двум: а) увеличивается в 5 раз; б) возрастает в 100 раз; в) увеличивается в 32 раза; г) увеличивается в 25 раз; д) увеличивается в 1,125·1015 раз.
5.5. Кинетическое уравнение отражает зависимость скорости химической реакции от:
а) стехиометрической концентрации реагентов; б) молекулярности; в) порядка; г) температуры; д) действия катализаторов.
5.6.Физический смысл константы скорости химической реакции: а) определяет скорость элементарной стадии;
б) определяет скорость, не зависящую от концентрации реагентов;
в) определяет зависимость скорости от количества реагентов;
г) определяет число частиц, участвующих в элементарной стадии;
д) определяет общее число столкновений в единице объема в единицу времени.
5.7.Природу
энергии активации (![]() ) раскрывает
теория:
) раскрывает
теория:
а) Вант-Гоффа; б) “активированного комплекса ” Эйринга и Поляни; в) изотермы химической реакции; г) “абсолютных скоростей”; д) Аррениуса.
5.8.Величина температурного коэффициента для реакции, скорость которой возрастает вдвое при увеличении температуры от 0°С до 10°С составляет:
а)10,0; б)5,0; в)2,0; г)0,5; д) 2,5.
5.9.Для реакции, протекающей
в две стадии NO(г) + Cl2(г)
®NOCl2(г) - быстро и NOCl2(г) + NO(г) ® 2NOCl(г) –
медленно, в соответствии с законом действия масс, скорость определиться
уравнением: а) ![]()
б) ![]()
в) ![]()
г) ![]()
д) ![]() .
.
5.10. Графически энергию активации можно определить как:
а) ![]()
![]()
![]()
![]() ln k б) ln k в) ln k г) ln k
ln k б) ln k в) ln k г) ln k


![]()
![]() a
а
a
а
![]() j
j
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.