


































Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
к практическим занятиям
по курсу общей физики
Составители С.А. Шатохин, Э.В. Сагитова
УДК [539.19+536](07)
ББК [22.36+22.317](Я7)
Основы молекулярной физики и термодинамики: Методические указания к практическим занятиям по курсу общей физики. / Уфимск. гос. авиац. техн. ун-т; Сост.: С.А. Шатохин, Э.В. Сагитова -Уфа, 2005. - 32 c.
Приведены примеры решения различных типов задач по темам практических занятий раздела «Основы молекулярной физики и термодинамики». Предназначены для студентов 1 и 2 курсов.
Библиогр.: 5 назв.
Рецензенты: А.С. Краузе
Э.З. Якупов
© Уфимский государственный
авиационный
Содержание
1. Молекулярно-кинетическая теория идеальных газов ............ 9
2. Основы термодинамики.......................................................... 15
Список литературы..................................................................... 32
Введение
Практические занятия являются одной из важнейших компонент учебного процесса по физике. Они способствуют приобщению студентов к самостоятельной работе, учат анализировать изучаемые физические явления, использовать на практике полученные теоретические знания.
Предназначены для студентов, изучающих раздел курса общей физики «Основы молекулярной физики и термодинамики». В методических указаниях представлены примеры решения типичных задач разной степени трудности. Решения сопровождаются необходимыми примерами и комментариями. Задачи систематизированы по основным темам раздела. Приведены основные формулы, облегчающие усвоение алгоритмов решения задач.
Основы молекулярной физики и термодинамики
Основные формулы
Количество вещества 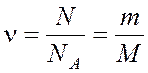 ,
,
где
N – число молекул,
NA – постоянная Авогадро,
m – масса вещества,
M – молярная масса.
Уравнение Менделеева- Клайперона
![]() ,
,
где
р – давление газа,
V – его объем,
R – молярная газовая постоянная,
T – термодинамическая температура.
Уравнение молекулярно – кинетической теории газов
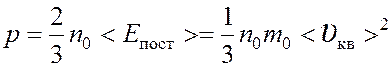 ,
,
где
n0 – концентрация молекул,
<Eпост> – средняя кинетическая энергия поступательного движения молекул,
m0 – масса молекулы,
<υкв> – средняя квадратичная скорость.
Средняя кинетическая энергия молекулы
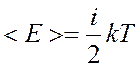 ,
,
где
i– число степеней свободы,
k – постоянная Больцмана.
Внутренняя энергия идеального газа
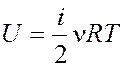 .
.
Скорости молекул:
средняя квадратичная 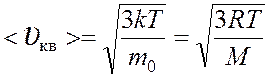 ,
,
средняя арифметическая 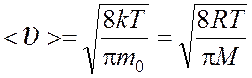 ,
,
наиболее вероятная 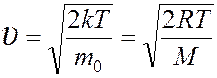 .
.
Средняя длина свободного пробега молекулы
![]() ,
,
где d – эффективный диаметр молекулы.
Среднее число столкновений молекулы в единицу времени
![]() .
.
Уравнение диффузии
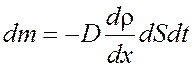 , где
, где
D – коэффициент диффузии,
Ρ – плотность,
dS – элементарная площадка, перпендикулярная к оси Х.
Уравнение теплопроводности
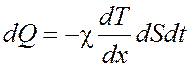 , где χ – коэффициент
теплопроводности.
, где χ – коэффициент
теплопроводности.
Сила
внутреннего трения 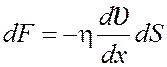 , гдеη – динамическая
вязкость.
, гдеη – динамическая
вязкость.
Коэффициент
диффузии 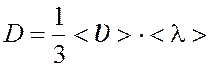 .
.
Вязкость
(динамическая) 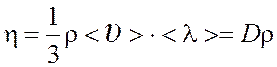 .
.
Теплопроводность
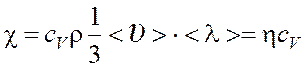 , где сV -
удельная изохорная теплоемкость.
, где сV -
удельная изохорная теплоемкость.
Молярная теплоемкость идеального газа:
Изохорная 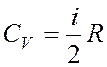 ,
,
Изобарная 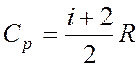 .
.
Первое начало термодинамики
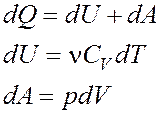
Работа расширения газа при процессе:
Изобарном ![]() ,
,
Изотермическом 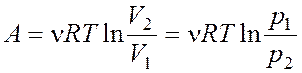 , адиабатном
, адиабатном
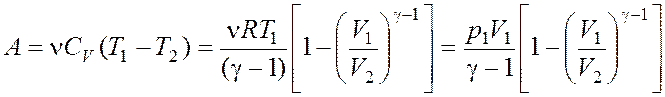 , где
, где 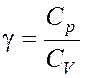 .
.
Уравнение Пуассона (уравнение адиабатного процесса)
![]() ,
, ![]() ,
, ![]() .
.
Коэффициент полезного действия цикла Карно
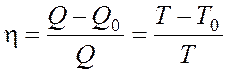 , где
, где
Qи T– количество теплоты, полученное от нагревателя, и его температура,
Q0 и T0 – количество теплоты, переданное холодильнику, и его температура.
Изменение энтропии при переходе из состояния 1 в состояние 2
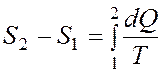
Уравнение Ван - дер - Ваальса:
для 1 моль газа 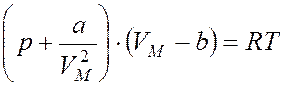 , для ν моль
газа
, для ν моль
газа 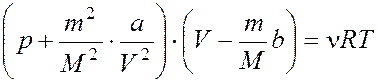 , где a и b
– постоянные Ван - дер - Ваальса,
, где a и b
– постоянные Ван - дер - Ваальса,
VM – объем 1 литра газа.
Критические
параметры 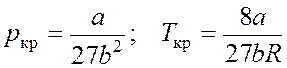 .
.
Собственный
объем молекулы 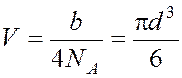 .
.
Высота поднятия жидкости в капилляре радиусом r
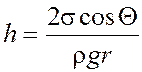 .
.
Примеры решения задач
1. Молекулярно-кинетическая теория идеальных газов
Задача 1. Определить, сколько киломолей и молекул водорода содержится в объеме 50 м3 под давлением 767 мм рт. ст. при температуре 18°С. Какова плотность и удельный объем газа?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.