Задача 15. Идеальный двухатомный газ, содержащий количество вещества n = 1 моль и находящийся под давлением Р1 = 0,1 МПа при температуре Т1 = 300 К, нагревают при постоянном объеме до давления Р2 = 0,2 МПа. После этого газ изотермически расширялся до начального давления и затем изобарно был сжат до начального объема V1. Построить график цикла. Определить температуру Т газа для характерных точек цикла и его термический КПД h.
|
Дано:
Р1= 0,1 Мпа = 1·105 Па Т1= 300 К Р2= 0,2 Мпа = 2·105 Па |
Решение:
|
|
T2 – ? Т3 – ? h – ? |
V1 V2 V |
Переход газа на участке 1-2 происходит изохорически при V1 = const. Давления и температуры газов в состояниях 1 и 2 связаны между собой соотношением:
 =
=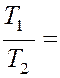
![]() .
.![]()
Отсюда T2 = 2Т1 = 600 K.
Так как переход газа 2-3 изотермический, то Т2 = Т3.
Термический
КПД цикла определяется выражением![]()
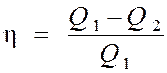 , (1)
, (1)
где Q1 – количество теплоты, полученное от нагревателя за цикл, Q2 – количество теплоты, отданное холодильнику за цикл.
Газ получает количество теплоты на участках 1-2 и 2-3
Q 1= Q 1-2 + Q 2-3, где Q 1-2 = C v v (T 2 - T 1) – количество теплоты, полученное при изохорическом нагревании,
![]() – количество теплоты, полученное при изотермическом
расширении.
– количество теплоты, полученное при изотермическом
расширении.
Газ отдает количество теплоты на участке 3-1 при изобарическом сжатии:
Q 3-1 = Q
2 = Cр ![]()
![]()
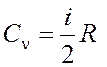 – молярная теплоемкость газа при V
= const, C р
– молярная теплоемкость газа при V
= const, C р 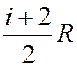 –
молярная теплоемкость газа при P = const.
–
молярная теплоемкость газа при P = const.![]()
Подставив
значения Q 1 и Q 2, С v
и С р![]() в
формулу (1) получим:
в
формулу (1) получим:
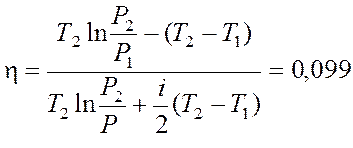 ,
, ![]()
Ответ: T 2 = T 3 = 600 K, η = 9,9 %.
Задача16. Кислород массой 1 кг совершает цикл Карно. При изотермическом расширении газа его объём увеличивается в 2 раза, а при последующем адиабатическом расширении совершается работа 3000 Дж. Определить работу, совершенную за цикл.
|
Дано: V2 = 2V1 A2-3 = 3000 Дж i = 5 |
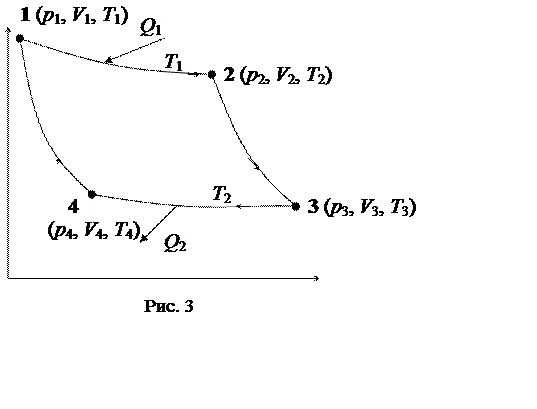
Решение: Идеальный цикл Карно состоит из двух изотерм и двух адиабат (рис. 3). |
|
А - ? |
На рисунке 3 участок 1-2 соответствует изотермическому расширению газа (Т1 = Т2), участок 2-3 – адиабатическому расширению газа, участок 3-4 – изотермическому сжатию (Т3 = Т4) и участок 4-1 – адиабатическому сжатию.
При изотермическом расширении внутренняя энергия идеального газа остается постоянной, следовательно, все подводимое тепло Q1 идет на работу по расширению газа на участке 1-2, т.е.
 |
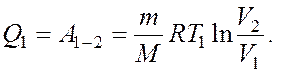 (1)
(1)
При изотермическом сжатии на участке 3-4 Q2 тепло отдается холодильнику (Q2), и это количество теплоты определяется работой, затраченной на сжатие газа:
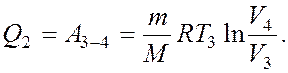 (2)
(2)
Состояния 2 и 3 лежат на одной адиабате, поэтому можно записать:
![]() (3)
(3)
Для состояний 4 и 1, которые отвечают одной адиабате, имеем:
![]() (4)
(4)
Поделив выражение (3) на (4), получим:
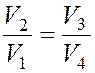 , (5)
, (5)
так как Т1 = Т2 и Т3 = Т4.
Работа при адиабатическом расширении на участке 2-3 равна:
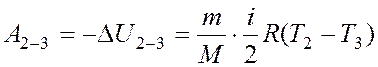 (6)
(6)
Работа при адиабатическом сжатии на участке 4-1 равна:
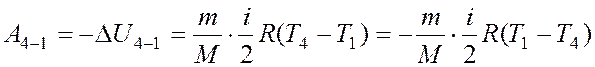 .
.
Так как Т1 = Т2, а Т3 = Т4, то А2 - 3 = -А4 - 1, т.е. полная работа по адиабатическому сжатию и расширению равна нулю.
Следовательно, работа цикла: А = А1-2 – А3-4.
Из уравнений (1), (2) и (5) получим: 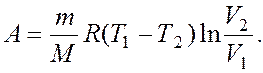 (7)
(7)
Из уравнения (6) выразим разность температур Т2
– Т3, равную Т1 – Т3, и
подставим в уравнение (7): 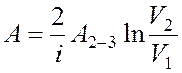 . Произведем
вычисления:
. Произведем
вычисления: 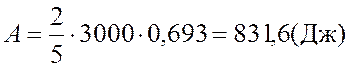 .
.
Ответ: 831,6 Дж.
Задача 17. В результате изотермического расширения объем 8 г кислорода увеличился в 2 раза. Определить изменение энтропии газа.
|
Дано:
M = 32 кг/кмоль V2 = 2V1 |
Решение: Изменение энтропии системы определяется по формуле:
где dQ– количества тепла, |
|
∆S - ? |
сообщенное газу, Т – абсолютная температура, S1 и S2 – значения энтропии в начальном и конечном состояниях системы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.