В термодинамике обычно не возникает необходимости использовать потенциальную энергию.
Предполагается, что кинетическая энергия системы либо равна нулю, либо пренебрежимо мало отличается от него. Следовательно, под энергией системы понимают ее внутреннюю энерги: DЕ = DU , для тер-модинамической системы.
В термодинамике и ее приложениях обычно бывает достаточно знать изменения внутренней энергии системы. То есть за нулевое значение может быть принято любое значение и в любом состоянии системы.
Чтобы судить об абсолютной величине U , необходимо обратиться к микроструктуре вещества и учесть строение, структуру его, строение молекул, атомов и так далее.
Согласно теории относительности: Е = mс2.
Закон сохранения энергии в общем виде можно записать:
DЕ = DU = å L i k + Q.
k=1
Механическая работа в термодинамических процессах считается положительной, когда деформация системы происходит с уменьшением внутренней энергии, то есть когда система совершает работу над окружающей средой.
Такое же правило законов применяют и для других видов работ, в связи с чем знаки количеств нетермических воздействий всегда противоположны знакам количеств соответствующих работ.
В дифференциальном виде можно записать:
dQ = dU + ådL ik .
k
В дальнейшем будим принимать во внимание только работу, совершенную термодинамической системой ® Li ® L.
dQ = dU + ådLk. (2.1)
k
Уравнение ( 2.1) представляет собой запись первого закона термодинамики. Физический смысл первого заrона термодинамики заключается в том, что теплота подведенная к системе частично возвращается в окружающую среду в виде различных видов работ, частично расходуется на изменение внутренней энергии системы.
Как было отмечено ранее, в термодинамике рассматриваются, как правило, простые термодеформационные системы. Следовательно к рассмотрению принимается только механическая работа деформации системы.
Тогда первый закон термодинамики можно записать в таком виде:
dQ = dU + dL
Q = DU + L (2.2)
Q1-2 = U2 - U1 + L1-2
Или в удельных величинах ( отнесенных к массе):
dq = dU + dl
q1- 2 =U2 - U1+ l1-2 (2.3)
Чтобы отпределить работу деформации замкнутой системы, следует рассмотреть бесконечно малое изменение объема, занимаемого рабочим телом. В термодинамике в качестве рабочих тел принимаются ( чаще всего) легкодеформируемые: пар, газ.
Рис. 2.1.
Газ, находящийся в оболочке, способен деформироваться и имеет давление Р1 равномерно распределенное по контрольной поверхности и уравновешенное наружным давлением Р. При бесконечно малом DР,контрольная поверхность ( КП) переместиться в сторону окружающей Среды на бесконечно малое расстояние dx, которое на разных участках контрольной поверхности может быть разным. Тогда работа на элементарном участке df будет:
dL = pdfdx dV
dL = pdV ® L1-2 =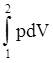 (2.4)
(2.4)
dl = pdu.
Рис.2.2.
В общем случае зависимость p от uможет быть любой. Следовательно работа термодинамического процесса 1-2 будет равна площади под кривой 12. Если зависимость другая, то и площадь будет 1 1 n 2 < 12, то есть L зависит от пути перехода системы из состояния 1 в состояние 2. А работа по замкнутому контуру не равна 0 , а Lф= площадь внутри цикла 12 n. Следовательно нельзя писать dL , а надо dL = L1-2. Следовательно L характеристика не системы, а совершаемого ею процесса.
В относительных величинах:
dq =du +dl = du + pdu
dq =du + pdu(2.5)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.