T1
T2
q
= ![]()
![]() ( T2 - T1
).
( T2 - T1
).
T1
T2 T2
![]() cdT =
cdT = ![]()
![]() ( T2 - T1 ).
( T2 - T1 ).
T1 T1
T2 T2
![]()
![]() = 1/ ( T2
- T1 )
= 1/ ( T2
- T1 ) ![]() cdT ®С = f(T).
cdT ®С = f(T).
T1 T1
T2
Поскольку
C = f(T), то решить ![]() cdT возможно, если
известна
cdT возможно, если
известна
T1
зависимость C = f(T). Такие зависимости для разных газов, в зависимости от их химической структуры различны. Для упрощения вычислений составлены справочные таблицы. При этом табличные теплоемкости классифицируются по следующим признакам:
- по количеству газа, к которому они относятся:
t2 t2 t1
![]() m
m ![]() =(
=( ![]() m
m ![]() t2
-
t2
- ![]() m
m![]() t1)
/ ( t2 - t1 );
t1)
/ ( t2 - t1 );
t1 o o
- по роду термодинамического процесса: u = const; p = const:
t2 t2 t1
![]() р
р ![]() =
qp / (t2 - t1) =(
=
qp / (t2 - t1) =( ![]() р
р ![]() t2
-
t2
- ![]() р
р ![]() t1)
/ ( t2 - t1 );
t1)
/ ( t2 - t1 );
t1 o o
- по интервалу температур:
t2 t2 t1
![]() u
u
![]() = qu /(t2-t1)
=(
= qu /(t2-t1)
=(![]() u
u ![]() t2 -
t2 - ![]() u
u ![]() t1) / ( t2 - t1
).
t1) / ( t2 - t1
).
t1 o o
Как было показано ранее (5.20):
Cp > Cu и Cp - Cu > 0.
Cp
- Cu =
Т (![]() p /
p / ![]() T)u (
T)u (![]() u /
u / ![]() T)p =T(R R)/( u p) = R
T)p =T(R R)/( u p) = R
²² RT
R/u R/p
Cp - Cu = R (6.7)
В термодинамике и ее приложениях широко используются следующие соотноешния:
Cp - Cu = 8314/М ;
Cp ¢ - Cu ¢ = rR;
k = Cp / Cu = MCp / MCu = Cp ¢ / Cu ¢ .
Для расчетов можно приближенно принять для:
- одноатомных газов k » 1,67;
- двухатомных k » 1,4;
- трехатомных k = 1,29.
Значение k может быть определены экспериментально® заманчиво через k определить значения Ср и Сu.
Ср - Сu = R и k = Ср / Сu; Ср = kCu.
kCu - Сu = R; Сu( k - 1) = R; k = 1+(R/Cu); Cu = R/(k-1);
Ср = kCu; Ср = kR/(k-1);
Сu ¢ = rо R/ (k-1); Сp ¢ = rо Rk / (k-1).
Вывод: зная k, можно рассчитать значения соответствующих теплоемкостей.
Кинетическая теория газа показывает, что давление (р) идеального газа на стенки сосуда может быть определено соотношением:
P = 2/3N (mW2/2), (6.8) где N - число молекул в 1 м3 объема; m - масса молекулы; W - средняя квадратичная скорость поступательного движения молекул:
W
= 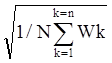
![]() ,
,
где Wk - скорость поступательного движения любой k-ой молекуле в газе данного состояния.
Умножим левую и правую части ( 6.8) на объем газа V:
PV = 2/3NV (mW2)/2 = 2/3N1 (mW2)/2,
где N1 = nV - число молекул газа в V. Для 1 моля:
Pvm = 2/3nNVm (mW2)/2 = 2/3Nm (mW2)/2.
Молярная внутренняя энергия газа равна кинетической энергии его молекул: заключенных в Vm: U = Nм (mW2 / 2) ® pVm = 2 /3 U ® U = 3 / 2 pVм ,так как pVм = MRT, то U = 2/3 MRT поскольку MR = 8314,4 то U » 12,48 Т; dU / dT = 12,48*.
В соответствии со сказанным ранее dU = MCu d1T® dU / dT =MCu**. Сопоставляя (*) и (**), можно записать:
MCu = 12,48 кДж/кмоль К (6.9)
Полученное выражение хорошо согласуется с найденными экспериментально значениями теплоемкостей для одноатомных газов. Это естествено, так как модель идеального газа наиболее полно соответсвует одноатомным газам.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.