Отложения смолы и кокса могут быть удалены окислительной регенерацией в токе газа, содержащего кислород. К счастью, эта процедура часто восстанавливает активность частично закоксованного катализатора. Например, катализатор крекинга подвергается такого рода регенерации в процессе работы тысячам раз.
Во втором случае, необходимо определить отравляющие вещества, затем удалить их из подаваемой в реактор смеси, используя боле устойчивые катализаторы или жертвуя катализатором, размещенным в предварительном слое.
Третий случай дезактивации должен быть исключен в норме на стадии приготовления катализатора на основе различных средств предотвращения рекристаллизации активной фазы.
При разработке реактора катализатор выбирается из каталога, исходя из имеющихся там данных. Наряду с кинетическими уравнениями процесса необходимо также рассматривать хотя бы одно уравнение дезактивации.
1.11.3. Кинетические уравнения дезактивации
Многие авторы пытаются описать существенную дезактивацию катализатора в кинетических уравнениях. Метод Левеншпиля является наиболее простым и общим. Он основан на использовании эмпирического соотношения, полученного без рассмотрения механизма дезактивации.
Утверждается, что если начальная скорость процесса может быть выражена в виде:
![]() ,
,
то скорость в момент времени t для любых условий:
![]() ,
,
где a = r/r0 – относительная активность. При этом изменение а от времени является функцией концентрации, температуры и активности а в момент времени t. В общем виде:
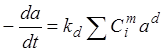
где
![]() - константа скорости
дезактивации,
- константа скорости
дезактивации,
![]() - суммарная
концентрация (одного или более) компонентов Аi.
- суммарная
концентрация (одного или более) компонентов Аi.
Эта общая формула согласуется с наблюдаемыми кинетиками дезактивации, например:
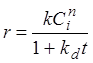 (гиперболическая форма)
(гиперболическая форма)
где
t – суммарное время (с),
kd – константа скорости дезактивации (1/с),
или
![]() (экспоненциальная форма)
(экспоненциальная форма)
или
![]() (p<0)
(p<0)
Характерные значения величин d, m
и суммарной концентрации ![]() лежат в пределах:
лежат в пределах:
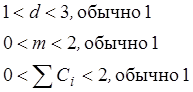
Различные уравнения соответствуют различным механизмам дезактивации.
1.11.4 Дезактивация в условиях внутридиффузионных ограничений
Для случая дезактивации при наличии диффузионных ограничений внутри пор установлено, что возможны 2 случая: равномерное отравление по всему объему пор и отравление в области поверхностного слоя частицы катализатора.
Определив a как долю
отравленного катализатора, можно показать, что в случае равномерного отравления
отношение F скорости с и без дезактивации равно (1-a) если эффективность h близка к 1. Если h<<1, ![]() .
.
Если отравление имеет место на входе в поры, то
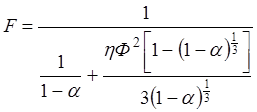
где Ф – модуль Тиле.
Если, например, Ф=10, h=3/Ф=0,3, и a = 0,10, то

Т.е. отравление 10% массы катализатора снижает скорость реакции на 32%.
Определение величины a для данного времени работы катализатора является проблемой. В этом случае как нельзя лучше подходит приближение Левеншпиля (см.1.11.3). Левеншпиль не определял степень отравления a, но устанавливал эмпирические соотношения для скоростей реакции и дезактивации. Или та, или другая скорость, или обе могут определяться внутренней диффузией. В особых случаях d, часто близкое к 1, может быть существенно выше наблюдаемых величин в зависимости от величины модуля Тиле (соответствующего или реакции или дезактивации) и зависит от модели дезактивации:

(а) Совместная дезактивация: А
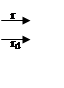 |
(б) Параллельная дезактивация: А B
A P
 |
(c) Последовательная дезактивация: А B P
 |
(д) Независимая дезактивация:
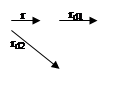 |
(е) Совместно-последовательная дезактивация: А B P
|
Хэнг и Левеншпиль получили решения для каждого из рассмотренных случаев.
Эксперименты показывают, что явление дезактивации является достаточно сложным и существующее многообразие моделей отражает его не в полной мере. Чаще применяются эмпирические соотношения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.