(г)Внешний концентрационный градиент может быть значительным (процесс ограничен внешней диффузией).
Для гетерогенных реакций с участием жидкой и газовой фаз применимы выводы, соответствующие жидкой фазе.
1.10 Кажущаяся энергия активации гетерогенных каталитических реакций
![]() (1.76)
(1.76)
где
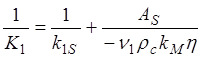 (1.77)
(1.77)
При другой температуре Тb¢ и той же самой С1b можно получить:
![]() (1.78)
(1.78)
где
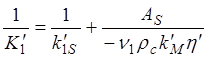 (1.79)
(1.79)
Отношение 2х кажущихся скоростей:
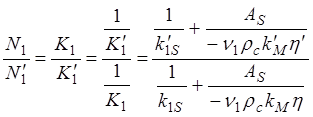 (1.80)
(1.80)
Кажущуюся энергию активации можно определить на основе соотношений (формальная запись закона Аррениуса):
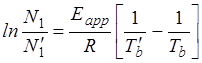 (1.81)
(1.81)
Тогда, используя (1.81) и (1.80), можно получить выражение для Еapp. Можно сравнить кажущуюся энергию активации с реальной:
 (1.82)
(1.82)
Сопоставляя (1.81) и (1.82):
 (1.83)
(1.83)
Несколько предельных случаев:
Случай (1)
Медленная реакция. В этом случае (см. 1.80, 1.83). При этих условиях:
![]() мал по сравнению с
мал по сравнению с 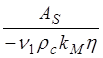 ,
,
![]() мал по сравнению с
мал по сравнению с .
.
h и h¢ остаются близкими к 1.
Поэтому:
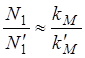 ,
(1.84)
,
(1.84)
следовательно
![]() (1.85)
(1.85)
Случай(2)
Очень быстрая реакция, полностью контролируется внешней диффузией. В этом случае:
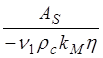 малая величина
по сравнению с
малая величина
по сравнению с ![]() ,
,
 малая
величина по сравнению с
малая
величина по сравнению с ![]() .
.
И, следовательно:
 (1.86)
(1.86)
Принимая во внимание реальные изменения k1S с температурой, можно получить, что кажущаяся энергия активации равна нескольким кДж/моль. Т.е. в рассматриваемом случае кажущаяся скорость реакции слабо зависит от температуры.
Случай (3)
Реакция быстрая, но не определяется внешней диффузии,
тепловыделение отсутствует, температура постоянна, как в жидкости (газе), так и
в частице. В этом случае, следовательно, 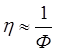 . (h - эффективность, Ф – модуль Тиле).
. (h - эффективность, Ф – модуль Тиле).
Следовательно,
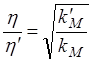 (1.87)
(1.87)
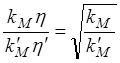 и
и 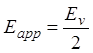 (1.88)
(1.88)
В общем случае экзо- или эндотермических быстрых реакций ситуация будет определяться соответствующими величинами модуля Тиле, коэффициентом переноса k1S, критерия Аррениуса и рассматриваемым температурным интервалом (температурой).
1.11. Дезактивация катализатора
В процессе работы, а иногда даже в период хранения катализатор может не всегда сохранять свои физические и химические свойства. Это ведет к дезактивации с изменяющейся скоростью и изменению степени превращения и селективности.
1.11.1. Механизмы дезактивации катализатора
Можно наблюдать три основных типа дезактивации:
(а) За счет отложений, блокирующих активные поры (кокса, серы…).
(б) За счет отравления веществами, содержащимися в исходном сырье, иногда в очень незначительных количествах. При этом яды химически связывают активные центры (хим. адсорбция) или физически (физ. адсорбция).
(в) За счет медленной реструктуризации катализатора в результате агрегирования или роста микрокристаллов, ведущей к прогрессивному снижению числа активных центров на единицу поверхности. Это, возможно, наиболее существенный механизм дезактивации.
1.11.2 Средства борьбы с различными формами дезактивации
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.