Таблица 3 – Приготовление буферных растворов
|
№ пробирки |
Количество, мл |
рН буферной смеси |
|
|
0,2 М р-ра гидрофосфата натрия |
0,1 М р-ра лимонной кислоты |
||
|
1 |
0,27 |
2,23 |
2,6 |
|
2 |
1,10 |
1,40 |
4,4 |
|
3 |
1,29 |
1,21 |
5,0 |
|
4 |
1,39 |
1,11 |
5,4 |
|
5 |
1,51 |
0,99 |
5,8 |
|
6 |
1,65 |
0,85 |
6,2 |
|
7 |
1,82 |
0,68 |
6,6 |
|
8 |
2,06 |
0,44 |
7,0 |
|
9 |
2,27 |
0,23 |
7,4 |
|
10 |
2,43 |
0,07 |
8,0 |
Затем в каждую пробирку приливали по 5 мл 2 %-ного раствора крахмала и по 2,5 мл экстракта солода. Содержимое пробирок после приливания экстракта тщательно перемешивали и оставляли на 10 минут. По прошествии этого времени брали через каждую минуту пробу (2-3 капли) из седьмой пробирки и добавляли две капли йода. Спустя 2 минуты после того, когда содержимое этой пробирки давало красно-бурое окрашивание, во все пробирки добавляли по несколько капель йода и взбалтывали. Раствор йода приливали, начиная с первой пробирки, через равные промежутки времени, т.е. через 30 секунд.
На основании полученной окраски содержимого пробирок можно судить о степени расщепления крахмала в зависимости от рН. Там, где получилась слабо-желтая окраска, крахмал расщепился полностью, и, следовательно, рН был оптимальным.
2.4.2 Изучение влияния температуры активность b-амилаз
В мерную колбу на 100 мл вносили 50 мл 2 %-ного раствора крахмала и 5 мл фосфатного буфера с рН 5,6. Содержимое колбы доводили до заданной температуры (нагревают или охлаждают), после чего вносили 5 мл ферментного препарата, предварительно термостатированного при той же температуре и замеряли время. Гидролиз продолжался 30 минут, в течение которых строго следили за поддержанием постоянной температуры. Через 30 минут в колбу вносили 10 мл раствора сернокислой меди ω(CuSO4) = 6 % для прекращения действия фермента, содержимое колбы охлаждали и доводили водой до метки.
Количество образовавшейся мальтозы определяли методом Бертрана.
Полученные результаты сводили в таблицу и строили график, характеризующий влияние температуры на активность β-амилазы.
2.4.3 Определение осахаривающей способности b-амилазы
В мерную колбу на 100 мл вносили 50 мл 2%-ного раствора крахмала и 5 мл фосфатного буфера с рН 5,6. Содержимое пробирки прогревали в водяной бане при 40 ºС в течение 15 минут. Затем в колбу вносили 5 мл ферментного препарата β-амилазы. Раствор в колбе перемешивали и снова ставили в водяную баню при той же температуре на 30 минут. По истечении этого времени ферментативный процесс гидролиза крахмала останавливали путем добавления 10 мл раствора сернокислой меди ω(CuSO4)= 6 %. После этого раствор охлаждали до комнатной температуры и доводили водой до метки. Количественное определение сахаров производили по методу Бертрана. Мерой активности β- амилазы служит количество разложившегося крахмала, выраженное в процентах от его первоначального веса.
Массовую долю сахарозы в продукте S, %, вычисляли по формуле (Fischer et al. 1975).
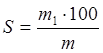 , где
, где ![]() - масса сахарозы,
содержащаяся в 20 мл фильтрата, г;
- масса сахарозы,
содержащаяся в 20 мл фильтрата, г;
![]() - масса продукта, соответствующая 20 мл
фильтрата, г.
- масса продукта, соответствующая 20 мл
фильтрата, г.
2.5 Исследование влияния условий солодаращения на амилолитическую активность ячменного солода из приморского ячменя Приморский 89
Для изучения влияния физико-химических факторов на накопление амилолитических ферментов в процессе солодоращения была приготовлена серия ячменных солодов из приморского ячменя сорта Приморский 89 в различных условиях (таблица 4). В каждом образце солода определяли амилолитическую активность по отработанному методу.
Таблица 4 – Условия солодоращения
|
№ образца |
Условия солодоращения |
||
|
Температура, оС |
рН |
Длительность, сут. |
|
|
контроль |
15 |
7,0 |
5 |
|
1 |
25 |
7,0 |
5 |
|
2 |
15 |
5,0 |
5 |
|
3 |
15 |
7,0 |
8 |
IIIрезультаты и обсуждение
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.