Фермент стабилен при рН 5–9, а оптимум рН 5–6. α-Амилаза имеет самый высокий для ферментов солода температурный оптимум 70 °С. Это еще одно существенное отличие α-амилазы от b-амилазы, которая в таких температурных условиях необратимо инактивируется. При 70 °С α-амилаза выдерживает нагревание в течение 20 мин, однако в естественных условиях – при затирании зернопродуктов – она еще более термостабильна за счет присутствия в среде субстрата (крахмала) (Хорунжин 1999).
По механизму действия α -амилаза относится к эндоферментам, т. е. оказывает декстринирующее действие на крахмал, гидролизуя α-1,4-глюкозидные связи внутри молекул как амилозы, так и амилопектина (рис. 1). При этом происходит разжижение и декстринизация крахмала, сопровождающаяся быстрым уменьшением вязкости среды. Если наблюдать ход этой ферментативной реакции по изменению окраски крахмала и продуктов его гидролиза с йодом, то получится следующая схема (Калунянц и др. 1992):
α-Амилаза дробит амилозу крахмала на остатки D-гексозы – шестичленные участки цепи, т. е. расщепляет ее в местах перехода спирали витков. Амилопектин ферментом гидролизуется как в основной, так и в боковой цепи. В среднем гидролизат амилозы содержит 13 % глюкозы и 87 % мальтозы, а гидролизат амилопектина – 73 % мальтозы, 8 % изомальтозы, 19 % глюкозы.
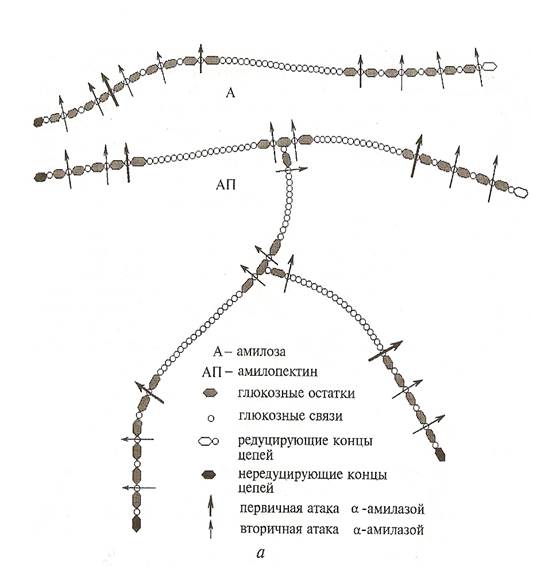
Рисунок 1 - Механизм действия α -амилазы
Под действием солодовой α-амилазы на крахмал зернопродуктов одновременно гидролизуются амилоза и амилопектин.
В прорастающем зерне 7 % α-амилазы находится в зародыше, 93 % – в эндосперме (Громов 1989; Рухлядева и др. 1981) .Активность фермента зависит от влажности, содержания кислорода в воздухе.
Как уже было сказано, α-амилаза является типичным компонентом солода и активируется только при прорастании ячменя. α-Амилазную активность можно обнаружить в ячмене лишь после длительного хранения его и в очень небольших количествах. Накопление α-амилазы активно происходит до четвертого дня ращения зерна, а затем ее содержание медленно возрастает до своего максимума в конце проращивания.
1.1.2 β -амилазы
β–Амилаза (К.Ф. 3.2.1.2), содержит 14,1 % азота. Активность ее существенно зависит от наличия SH-групп и тирозина, т. е. инактивировать фермент будут вещества, окисляющие сульфгидрильную группу до дисульфидной или вступающие с ней во взаимодействие, например соли тяжелых металлов, меди, серебра, ртути. Причем если первый вид инактивации обратим, то во втором случае фермент реактивировать значительно труднее (ГОСТ 29294-92;Струппуль 2007)
β-Амилаза имеет температурный оптимум в области 60 °С, рН-оптимум 4,5–5,0. По механизму действия β-амилаза относится к экзоферментам, т. е. действует на α-1,4-глюкозидные связи с нередуцирующего конца, отщепляя мальтозу. Другими словами, β-амилаза обладает осахаривающим действием (рис. 2)(Мальцев 1980;Терновский 1994).
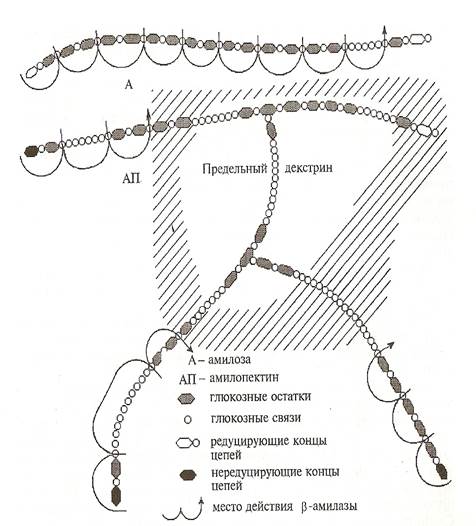
Рисунок 2 - Механизм действия β-амилазы
Мальтоза образуется в оптической β-форме. При этом синяя окраска амилозы с йодом долго не изменяется. Это объясняется тем, что остатки цепочек сохраняют характер амилозы. Когда они становятся совсем короткими, синяя окраска среды через фиолетовую и красную совершенно исчезает. Гидролиз ферментом основной и боковой цепи в амилопектине идет вплоть до мест разветвления, до α-1,6-глюкозидных связей, перед которыми гидролиз прекращается. Около 60 % амилопектина расщепляется до мальтозы и высокомолекулярных декстринов. Эти декстрины дают с раствором йода красную окраску, не сбраживаются и не обладают восстанавливающей способностью.
1.1.3 Предельная декстриназа
Предельные декстрины, которые образуются при действии α- и β- амилаз на амилопектин и ими не расщепляются, гидролизуются этим ферментом. Он расщепляет α- 1,6 – глюкозидные связи и превращает предельные декстрины в мальтозу, мальтотриозу, мальтотетроозу, в результате чего повышается конечная степень сбраживания сусла. Наибольшую активность фермент проявляет на 6ой день проращивания. Свойства фермента: температурный оптимум 40 ºС, инактивируется при 65 ºС, pH – оптимум 5,1.
Амилопектин и β – предельный декстрин могут также гидролизоваться под действием специфического амилолитического фермента солода – амилопектин – 1,6 – глюкозидазы. Свойства фермента: температурный оптимум 40 ºС, инактивируется при 70 ºС и при pH 3,5; pH – оптимум 5,1.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.