Научить студентов применять следующие понятия и законы: длина свободного пробега молекул, среднее число соударений в единицу времени, эффективный диаметр и эффективное сечение молекул. Показать, что перенос массы вещества, передача импульса и теплоты объединяются общим понятием: явления переноса, поскольку механизм данных процессов – хаотическое тепловое движение атомов и молекул.
Задачи данного раздела посвящены применению эмпирических законов переноса в газообразных средах, как наиболее простых. В жидких и твёрдых телах процессы переноса значительно сложнее по своему механизму, поэтому в данном разделе не рассматриваются,
Анализ задач начинается с определения эффективных значений параметров молекул: эффективного диаметра и сечения, а также средних значений скоростей их хаотического теплового движения. Для лучшего понимания рассматриваемых явлений важно привлекать молекулярно-кинетические представления. Обратить особое внимание на взаимосвязь коэффициентов переноса и их зависимость от давления и температуры. Показать, что состояние вакуума обусловлено не давлением в сосуде, а в первую очередь длиной свободного пробега молекулы.
[2] 3.6; 4.1-4.4; [6] стр. 267-270.
Пример 1. Найти число всех столкновений Z, которые
происходят в течение секунды между всеми молекулами водорода ![]() , находящимися в сосуде емкостью
20,0 л при температуре 300 К и давлении 101 кПа. Газ считать
идеальным.
, находящимися в сосуде емкостью
20,0 л при температуре 300 К и давлении 101 кПа. Газ считать
идеальным.
|
Дано: |
Решение |
|
|
Среднее число соударений, испытываемых одной молекулой газа за 1 с,
где |
Если умножить число столкновений ![]() ,
испытываемых одной молекулой за 1 с, на число
,
испытываемых одной молекулой за 1 с, на число ![]() (где
(где ![]() – число всех молекул, а единицу
вычитаем, так как молекула сама с собой не сталкивается), то получится
результат, превышающий в два раза искомое число
– число всех молекул, а единицу
вычитаем, так как молекула сама с собой не сталкивается), то получится
результат, превышающий в два раза искомое число ![]() . Действительно,
в одном столкновении участвуют сразу две молекулы, поэтому в число
. Действительно,
в одном столкновении участвуют сразу две молекулы, поэтому в число ![]() каждое столкновение входит дважды: один
раз в счет столкновений первой молекулы данной пары, другой раз – в счет
столкновений второй молекулы той же пары. Следовательно, правильным будет
следующее выражение:
каждое столкновение входит дважды: один
раз в счет столкновений первой молекулы данной пары, другой раз – в счет
столкновений второй молекулы той же пары. Следовательно, правильным будет
следующее выражение:
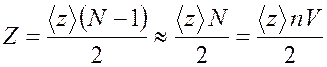 . (16.2)
. (16.2)
Подставив формулу (16.1) в выражение (16.2), получим
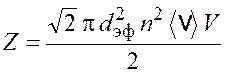 . (16.3)
. (16.3)
Концентрацию молекул найдем по формуле
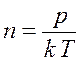 ,
(16.4)
,
(16.4)
где ![]() – постоянная Больцмана.
– постоянная Больцмана.
Средняя скорость молекул
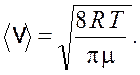 (16.5)
(16.5)
Подставив формулы (16.4) и (16.5) в выражение (16.3), получим
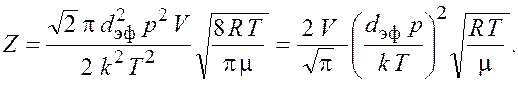
Подставим числовые значения и получим
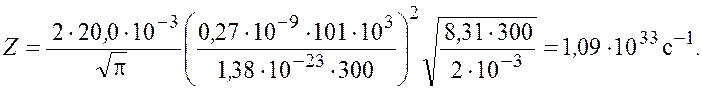
Ответ: ![]()
Пример 2. Находящийся между стенками дюаровского сосуда воздух при температуре 20 °С оказывает давление 333 мкПа. Найти давление на стенки сосуда, если в него налить жидкий азот при температуре 78 К. Температура наружных стенок неизменна. Расстояние между стенками равно 1 см.
|
Дано: |
Решение |
|
|
Найдем среднюю длину свободного пробега молекул воздуха, заключенного между стенками дюаровского сосуда,
|
где ![]() – эффективный диаметр
молекул;
– эффективный диаметр
молекул; ![]() – концентрация
молекул; k – постоянная
Больцмана; T – термодинамическая
температура; p –
давление.
– концентрация
молекул; k – постоянная
Больцмана; T – термодинамическая
температура; p –
давление.
Эффективный диаметр молекул воздуха примем равным ![]() м. Подставим числовые значения и
получим
м. Подставим числовые значения и
получим
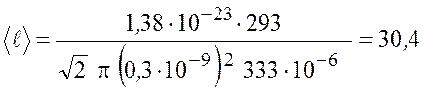 м.
м.
Таким образом, ![]() . Следовательно,
соударениями молекул друг с другом можно пренебречь и учитывать только удары молекул
о стенки сосуда.
. Следовательно,
соударениями молекул друг с другом можно пренебречь и учитывать только удары молекул
о стенки сосуда.
Можно предположить, что в пространстве между стенками дюаровского
сосуда имеются как бы два встречных потока молекул. Один поток состоит из
молекул, летящих от более нагретой стенки со среднеквадратичной скоростью ![]() и имеющих среднюю энергию, соответствующую
температуре
и имеющих среднюю энергию, соответствующую
температуре ![]() . Другой поток состоит из молекул, летящих
от холодной стенки со среднеквадратичной скоростью
. Другой поток состоит из молекул, летящих
от холодной стенки со среднеквадратичной скоростью ![]() и
имеющих среднюю энергию, соответствующую температуре
и
имеющих среднюю энергию, соответствующую температуре ![]() .
Среднеквадратичные скорости молекул рассчитываются по следующим формулам:
.
Среднеквадратичные скорости молекул рассчитываются по следующим формулам:
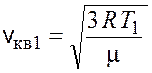 ,
, 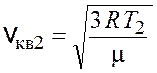 .
(17.2)
.
(17.2)
Молекулы газа подлетают к стенке с одной скоростью, а после взаимодействия со стенкой отлетают с другой скоростью, соответствующей температуре стенки. Механизм изменения скорости выглядит следующим образом. На поверхности каждой стенки существует слой адсорбированных молекул газа (в нашем случае кислорода и азота). Температура слоя равна температуре стенок. Этот слой молекул находится в динамическом равновесии с молекулами газа: молекулы из объема газа подлетают к стенке и “прилипают” к ней; одновременно из слоя вылетают, “испаряются” молекулы (происходит реадсорбция молекул) со средней кинетической энергией, соответствующей температуре стенки. Импульс силы, который получает стенка в результате этих двух процессов, такой же, как при отражении молекул от стенки, а не как при поглощении. Подлетающую и отлетающую молекулы можно рассматривать как одну молекулу, претерпевшую частично упругий удар о стенку.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.