Рис.1.4. Пространственное квантование и эффект Зеемана для спина электрона.
В
настоящее время спин и его свойства понимаются как необходимое и естественное
следствие комбинации теории относительности и квантовой механики. В атомной
физике МКД часто изображается соответствующими квантовыми числами. Например, mz
= Mz/![]() или msz = Msz/
или msz = Msz/![]() .
.
1.10. Полный момент количества движения.
В случае одного электрона полный МКД будет равен геометрической сумме векторов спинового и орбитального МКД вдоль оси Z: j = l + s. Значение j определяет число энергетических подуровней атома в магнитном поле, которое равно 2j + 1. Для р-электрона при jmax = 3/2 j принимает следующие значения: +3/2, +1/2, -1/2 и -3/2, а при jmax = 1/2 : +1/2 и -1/2. В первом случае говорят о четырехкратном вырождении уровня МКД, а во втором – о двукратном. Для d-электрона при jmax = 5/2 имеет место шестикратное вырождение, а при jmax = 3/2 – четырехкратное. Схемы расщепления уровней для p- и d-состояний электрона представлены на рис.1.5.
В действительности энергетические состояния с разными значениями j отличаются по энергии и в отсутствии внешнего магнитного поля. Расщепление возникает за счет взаимодействия спинового и орбитального магнитных моментов электрона. Оценим величину этого взаимодействия. Два магнитных диполя на расстоянии rобладают потенциальной энергией равной
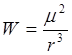 .
(1.45)
.
(1.45)
Здесь r - расстояние порядка боровского радиуса
r =![]() .
.![]() (1.46)
(1.46)
|
j = 5/2 j = 3/2 l = 1 l = 2 j = 1/2 j = 3/2 p-состояние d-состояние |
Рис.1.5. Расщепление p- и d-состояний в магнитном поле.
Таким образом, расщепление по порядку величины составит:
DE
= W = 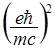 /
/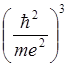 . (1.47)
. (1.47)
DE
= ![]() /
/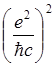 . (1.48)
. (1.48)
Множитель
e2/r есть потенциальная (кулоновская) энергия
электрона на орбите и близка по своей величине энергии атома. Второй
сомножитель ![]() не
имеет размерности и равен 1/137 (постоянная тонкой структуры). Т.о. величина
расщепления, связанная со спин-орбитальным взаимодействием в (137)2
раз меньше энергии атома. Данный упрощённый расчёт проведён для атома водорода.
В общем случае для любого атома расчёты показывают, что величина
спин-орбитального взаимодействия сильно возрастает с увеличением заряда ядра (Z4).
не
имеет размерности и равен 1/137 (постоянная тонкой структуры). Т.о. величина
расщепления, связанная со спин-орбитальным взаимодействием в (137)2
раз меньше энергии атома. Данный упрощённый расчёт проведён для атома водорода.
В общем случае для любого атома расчёты показывают, что величина
спин-орбитального взаимодействия сильно возрастает с увеличением заряда ядра (Z4).
1.11. Термы состояния атома
1.11.1. Мультиплетность.
Рассмотрим систему из двух электронов. Проблема взаимодействия двух электронов является ключевой в квантовой химии, ибо именно взаимодействие двух электронов объясняет природу химической связи.
В атоме с двумя электронами у каждого из электронов имеются свои орбитальный и спиновый моменты: l1, l2 и s1, s2. В s-состоянии l1 = l2 = 0, s1 = s2 = 1/2. Результирующий МКД будет результатом комбинаций двух спинов:
msz = msz* + msz** = (±1/2) + (±1/2) = +1, 0, 0, -1.
Значения +1 и -1 получаются, когда спины электронов параллельны, но направлены в разные стороны (,¯¯) относительно оси Z и S = 0, когда спины антипараллельны (¯). Состояние с S = 0 в магнитном поле не расщепляется, а состояние с S = 1 расщепляется на три уровня. Состояния с различными суммарными спинами (S), независимо от числа электронов в системе, называются мультиплетностью и имеют индивидуальные обозначения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.