В 60-е годы XX века появились первые работы, посвященные не только феноменологическому описанию методик синтеза глюконовой кислоты, но и исследованию кинетики реакции и ее механизма. Окада и др. предложили математическую модель реакции окисления глюкозы до конверсии субстрата 30%. На основании эмпирических данных они создали бимолекулярную кинетическую модель второго порядка с логарифмической поправкой, относящейся к дезактивации катализатора в ходе эксперимента [[44]].
De Wilt и соавторами была разработана кинетическая модель типа Ленгмюра-Хеншильвуда, основанная на механизме дегидрирования и адсорбции субстрата и кислотных продуктов на поверхности платино-углеродного катализатора [[45], [46]]. Для создания данной модели авторы приняли предложенный ранее Heyns и др. механизм окислительного дегидрирования. Согласно этому механизму, на первом этапе реакции в растворе происходит гидратирование альдегидной группы с образованием гем-диола (Рис. 4а), который адсорбируется на поверхности благородного металла (Рис. 4б) с последующим дегидрированием (Рис. 4в), после чего поверхность благородного металла «очищается» молекулярным кислородом (Рис. 4 г).
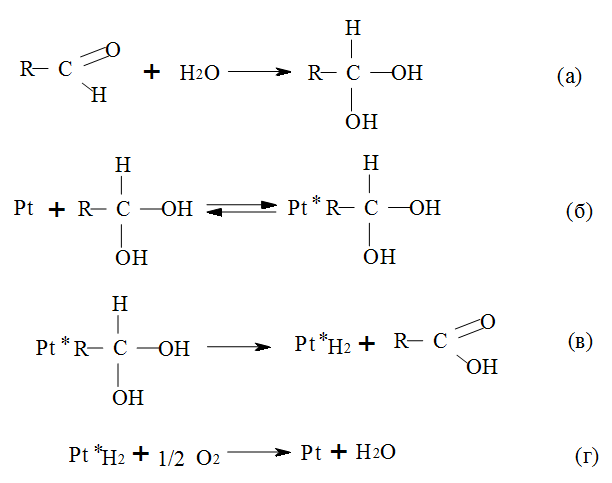
Рис. 4. Механизм селективного каталитического окисления сахаров, предложенный de Wilt [46].
Dirkx и van der Baan предположили, что в ходе реакции происходит диссоциативная адсорбция кислорода, и поверхностные оксиды платины участвуют в селективном окислении глюкозы, а также в процессе дезактивации катализатора (см. раздел 2.4. Дезактивация катализатора). Проведя аналогию с другими реакциями окисления, авторы высказали предположение, что слабосвязанный с платиной кислород при взаимодействии с адсорбированной глюкозой окисляет С6-спиртовую группу с образованием побочного продукта диальдегида (Рис. 5). Для получения целевого продукта реакции глюконовой кислоты необходима реакция с поверхностными оксидами Pt-O либо PtO2 (Рис. 5).
2Pt + O2 → 2Pt-O
Pt + O2 ↔ 2Pt·O2 (слабое взаимодействие)
Pt + Глюкоза ↔ Pt-Глюкоза
Pt-O + Pt-Глюкоза → Pt-(Глюконовая кислота) + Pt
Pt·O2 + Pt-O + Pt-Глюкоза → Pt-(Глюконовая кислота) + Pt + PtO2
Pt·O2 + Pt + Pt-Глюкоза → Pt-(Глюконовый диальдегид) + 2Pt + H2O2
Pt·O2 + Pt-Глюкоза → Pt-(Глюконовая кислота) + Pt + H2O2
Pt-Глюкоза ↔ Pt + Глюконовая кислота
Pt-(Глюконовый диальдегид) ↔ Pt + Глюконовый диальдегид
Рис. 5. Механизм селективного каталитического окисления сахаров, предложенный de Wilt [46].
Механизм окислительного дегидрирования был подтвержден изотопным методом с использованием меченого кислорода в качестве окислительного агента. В продуктах окисления меченый кислорода обнаружен не был [[47]].
В работе [[48]] в результе электрохимического исследования авторы установили, что основной причиной отравления платинового катализатора в процессе окисления метил-α-D-глюкопиранозида является окисление поверхности. На основании экспериментальных данных была предложена кинетическая модель окисления с учетом дезактивации катализатора.
В пользу механизма дегидрирования свидетельствуют также результаты работы de Wit и сотр. в которой, изучалась реакция дегидрирования альдоз на платиновых и родиевых катализаторах до альдонат-ионов и молекулярного водорода при комнатной температуре в щелочной среде (pH >11) [[49]]. В щелочном растворе, содержащем глюкозу и фруктозу, происходит дегидрирование глюкозы в глюконат-ион и восстановление фруктозы выделяющимся водородом в маннитол и сорбитол [[50]].
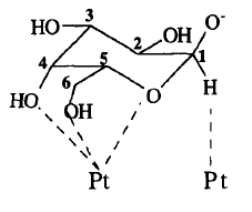
Рис. 6. Поверхностный комплекс галактозы с платиной [49].
Предположительно дегидрирование глюкозы протекает через образование комплекса между поверхностными атомами платины и депротонированной альдозой, после чего происходит перенос гидрида на поверхность металла и образование карбонильной группы [49]. Различные альдозы имеют разную каталитическую активность именно в силу разного пространственного расположения гидроксильных групп: D-галактоза, например, более реакционноспособна, чем глюкоза, за счет наличия у нее аксиальной C4-гидроксильной группы (Рис. 6).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.