Эта группа веществ называется ионогенами. Типичным представителем ионогенов является уксусная кислота. Процесс образования ионов при растворении уксусной кислоты, например в воде, можно передать совокупностью следующих реакций
1) химическое взаимодействие с растворителем:
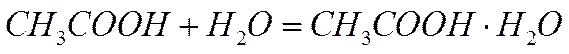
приводящее к образованию молекулярного комплекса;
2) превращение молекулярного комплекса в ионный двойник за счет внутримолекулярной перегруппировки:
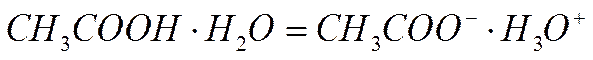
3) распад ионного двойника на свободные ионы:
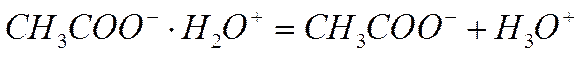
причем равновесие последней реакции смещено как правило (за исключением очень разбавленных растворов) влево. Ионогены в водных растворах поэтому обычно слабые электролиты и плохие проводники электрического тока.
По Фуоссу и Краусу (1934—1935 гг.), в концентрированных растворах, кроме незаряженных ионных двойников, можно ожидать также образования ионных тройников, в которых заряды ионов не уничтожаются:
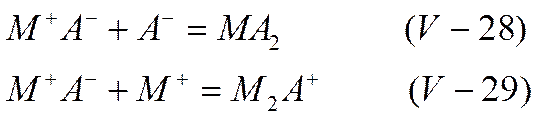
Образование ионных тройников можно представить себе так же, как результат ассоциации двух ионных пар с последующей ионизацией возникших комплексов:
![]()
и
![]()
Представление об ионных тройниках позволяет объяснить появление минимума на кривой эквивалентная электропроводность — разведение (λ — V). Действительно, в области больших разбавлений в растворе присутствуют исключительно простые молекулы
электролита и отвечающие им простые ионы. При увеличении концентрации эквивалентная электропроводность упадет, так как равновесие между ионами и молекулами, описываемое в этой области уравнением (V-27), должно сместиться в левую сторону, т. е. в сторону недиссоциированных молекул. По мере дальнейшего роста концентрации становится возможным образование ионных тройников по реакциям (V-30) и (V-31) и электропроводность начнет расти за счет их прямого участия в переносе тока. Основываясь на этих соображениях, Фуосс и Краус вывели уравнение зависимости эквивалентной электропроводности от концентрации электролита
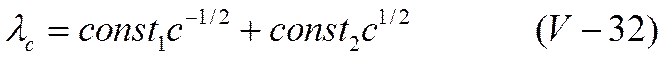
Постоянные уравнения (V-32) зависят от констант равновесия реакций (V-27), (V-28) и (V-29) и от предельных значений эквивалентной электропроводности при концентрациях частиц МА, МА~ и М2А+, равных нулю. Уравнение (V-32) описывает кривую с минимумом, причем можно показать, что концентрацию, отвечающую наименьшей электропроводности, легко определить, если известны константы равновесия реакций образования ионных тройников и величины их предельной электропроводности.
При переходе к неводным растворителям с низкими диэлектрическими постоянными различие между иоиофорами и ионогенами проявляется не столь отчетливо. Здесь в обоих случаях существенное значение приобретает химическое взаимодействие между растворителем и растворенным веществом. Например, в жидком аммиаке проводимость хлорида калия и уксусной кислоты (присутствующей в виде ацетата аммония) оказывается близкой как по величине, так и по характеру изменения с концентрацией растворенного вещества
Чтобы объяснить появление максимума на кривой электропроводности, часто наблюдаемого в концентрированных неводных растворах электролитов, необходимо вслед за Сахановым допустить существование наряду с заряженными ионными тройниками также незаряженных ассоциированных соединений. Они могут возникать, например, по реакции
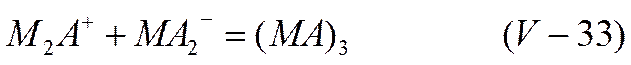
В настоящее время экспериментально доказано присутствие в такого рода растворах и заряженных, и незаряженных ассоциированных частиц. Влияние подобных комплексов на свойства растворов электролитов не ограничивается только явлениями электропроводности. Его необходимо учитывать и при рассмотрении равновесия в растворах электролитов. Образование ионных двойников, тройников и незаряженных комплексов должно сказываться также на протекании других процессов в растворах электролитов, например диффузии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.