УЧЕТ СИЛ ВЗАИМОДЕЙСТВИЯ
Основные положения теории электропроводности Дебая — Онзагера
Расхождения между опытом и классической теорией электропроводности вызываются тем, что в ней не учитываются силы взаимодействия между частицами раствора, прежде всего между ионами электролита друг с другом, а также и между ионами электролита и молекулами растворителя.
Межионное взаимодействие при неравновесных процессах, в частности при прохождении электрического тока через растворы электролитов (явление электропроводности), должно иметь иной характер, чем в условиях равновесия. Предложенный Бьеррумом коэффициент электропроводности f λ вносит поправку на силы взаимодействия при прохождении тока через растворы электролитов. Коэффициент электропроводности f λ, отличается от коэффициента активности f, относящегося только к равновесным растворам. При учете коэффициента электропроводности вместо уравнения (IV-29) в приложении его к 1-1 валентным электролитам (z=1) следует писать
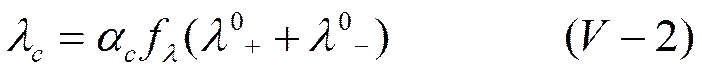
или

Для растворов слабых электролитов коэффициент электропроводности f λ, близок к единице и отношение электропроводностей будет отвечать степени диссоциации. Для сильных электролитов, где α = 1,

Величина коэффициента электропроводности f λ должна быть функцией концентрации и ее можно определить экспериментально. Теоретический расчет f λ основан на определенных представлениях о строении растворов, а также на учете характера изменений, происходящих в растворах под влиянием приложенного электрического поля. Воспользуемся моделью раствора, предложенной Дебаем и Гюккелем, согласно которой каждый ион окружен ионной атмосферой со знаком заряда, противоположным заряду центрального иона. Предположим, что сильные электролиты диссоциированы полностью (α = 1) и все изменения эквивалентной электропроводности с концентрацией обусловлены изменением энергии взаимодействия. Тогда в бесконечно разбавленном растворе, где ионы настолько удалены друг от друга, что силы взаимодействия между ними уже не могут проявляться, ионная атмосфера не образуется и раствор электролита ведет себя подобно идеальной газовой системе. В этих условиях эквивалентная электропроводность электролита будет наибольшей и равной λ0*.
В действительности при концентрации электролита, отличной от нуля, в растворе проявляются силы, которые тормозят движение ионов и, следовательно, уменьшают его эквивалентную электропроводность на величины λ i, каждая из которых отвечает определенному типу сил взаимодействия. На этом основании вместо уравнения (V-4) можно написать

где Σλi, —суммарное уменьшение эквивалентной электропроводности раствора за счет всех эффектов взаимодействия, проявляющихся в реальных растворах. Происхождение одного из этих эффектов становится понятным, если учесть, что при наложении внешнего поля центральный ион и ионная атмосфера (как обладающие зарядами, одинаковыми по величине, но обратными по знаку) должны двигаться в противоположных направлениях (рис. 15).
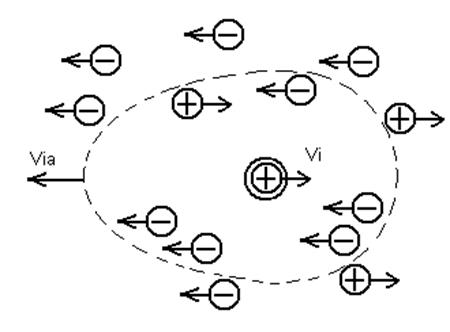
Рис.15 Движение центрального иона и ионной атмосферы в электрическом поле.
Так как все ионы гидратированы, движение центрального иона co скоростью vi происходит не в неподвижной среде, а в среде, перемещающейся в противоположном направлении со скоростью via. Сила трения, как известно, пропорциональна скорости движения частицы и в реальном растворе ее величина определяется уравнением
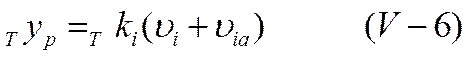
в то время как для идеального раствора она равнялась бы

где Tki—коэффициент внутреннего трения.
Уменьшение электропроводности должно быть пропорционально возросшей силе трения. Если обозначить через λ*I изменение эквивалентной электропроводности раствора, обусловленное этим эффектом, то

ИЛИ
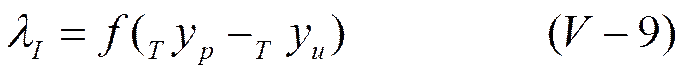
Дополнительная сила трения, связанная с существованием ионной атмосферы и ее перемещением в сторону, противоположную движению центрального иона, была названа электрофоретической силой трения, а вызванный ею эффект торможения — электрофоретическим эффектом.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.