Таким образом, при заданных температуре и давлении электропроводность любых систем, составленных из растворенного вещества и растворителя, определяется природой химических связей между частицами растворенного вещества в их исходном состоянии, характером взаимодействия растворителя и растворенного вещества, диэлектрической постоянной растворителя и вязкостью раствора. Последние два фактора играют особенно важную роль в случае индифферентных растворителей. Как показал Ю. Я. Фиалков (1965—1966), в этом случае наблюдается линейная связь между логарифмом произведения вязкости на электропроводность и величиной, обратной диэлектрической постоянной раствора. Он нашел, что если отношение вязкости электролита к вязкости растворителя превосходит некоторую критическую величину, на кривой удельная электропроводность — концентрация появляется максимум.
Электропроводность растворов некоторых металлов в жидком аммиаке
Кривые, подобные кривым аномальной электропроводности электролитов в неводных органических растворителях, были получены при изучении растворов щелочных и щелочноземельных металлов в жидком аммиаке. На кривой молекулярной электропроводности раствора калия в жидком аммиаке (рис. 16) при определенном составе раствора наблюдается минимум проводимости, после чего она закономерно растет с разведением, приближаясь к некоторому предельному значению. Можно было бы, воспользовавшись формальной аналогией между аномальной электропроводностью и электропроводностью растворов металлов в жидком аммиаке, попытаться и здесь применить представления об образовании ионных комплексов. Однако проводимость растворов металлов в жидком аммиаке настолько велика, что ионы (и комплексные, и простые) не в состоянии ее обеспечить. Эти интересные растворы значительно отличаются по своей природе от растворов электролитов в воде или в органических растворителях.
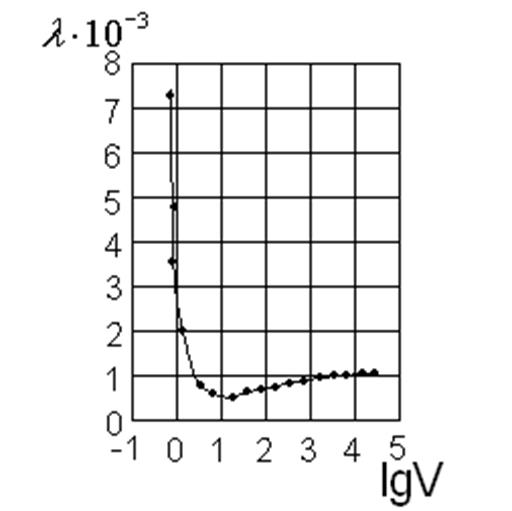
Рис.16. Зависимость молекулярной электропроводности натрия в жидком аммиаке от разведения.
Жидкий аммиак представляет собой растворитель, напоминающий в некоторых отношениях воду. Константа диссоциации воды при обычных температурах близка к 10-14. В жидком аммиаке тоже существует равновесие, подобное (V-34)
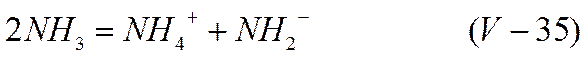
однако константа равновесия этой реакции составляет (по Моносзону и Плескову) при —33° С примерно 10-33, что на много порядков меньше константы диссоциации воды. Собственная проводимость жидкого аммиака поэтому заметно ниже, чем воды. Как и вода, жидкий аммиак способен растворять значительные количества щелочных металлов. Так, например, при —33,7° C 1 г-атом лития растворяется в 3,7 моль, 1 г-атом натрия — в 5,5 моль и 1 г-атом калия в 5,0 моль жидкого аммиака. Но в отличие от воды растворение щелочных металлов в жидком аммиаке не сопровождается разложением растворителя и выделением газообразного водорода. На основании этого, а также некоторых других данных, процесс растворения щелочных металлов в жидком аммиаке можно описать уравнением
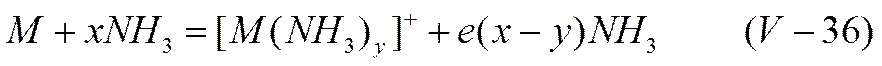
Следовательно, ток в подобных растворах должен переносить ионы металла и электроны, сольватированные аммиаком. Уравнение (V-36) позволяет объяснить наблюдаемое на опыте изменение электропроводности с разведением. В области растворов, близких к насыщенным, степень сольватации ионов и электронов ничтожно мала (х ->0). Электроны в таких растворах ведут себя подобно свободным электронам в металлах, и их электропроводность должна незначительно отличаться по своей величине от металлической. Для насыщенного раствора калия в жидком аммиаке удельная электропроводность составляет 0,5-104 ом-1-см-1. Эта величина вполне сравнима с удельной электропроводностью такого металлического проводника, как ртуть (1 ·104 ом-1 -см-1). В то же время максимальная удельная электропроводность водного раствора серной кислоты — одного из лучших ионных проводников — достигает всего 0,7 (ом-1 -см-1, т. е. почти на четыре порядка ниже удельной проводимости насыщенного раствора калия в жидком аммиаке. При разведении степень сольватации электронов увеличивается (х растет), их подвижность значительно уменьшается и наблюдается резкое падение электропроводности раствора. При еще больших разведениях степень сольватации перестает изменяться, но степень диссоциации продолжает расти, что приводит к подъему молекулярной проводимости. Предельное значение молекулярной электропроводности при бесконечном разведении в несколько раз превосходит кислоты.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.