Другой тормозящий эффект также связан с существованием ионной атмосферы и ее влиянием на движение ионов. Было установлено, что образование и разрушение ионной атмосферы протекает с большой, но с конечной скоростью. Характеристикой этой скорости служит так называемое время релаксации τr, которое можно рассматривать как величину, обратную константе скорости создания или разрушения ионной атмосферы.
Время релаксации зависит от ионной силы раствора, его вязкости и диэлектрической постоянной и выражается уравнением

где Tk — коэффициент внутреннего трения раствора; k — константа Больцмана; Т — абсолютная температура и χ — характеристическая длина по теории Дебая и Гюккеля. Для водного раствора 1-1 валентного электролита уравнение (V-10) упрощается и время релаксации можно приближенно рассчитать по уравнению
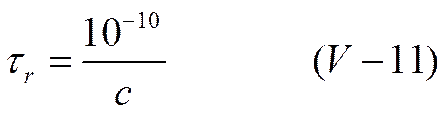
где с — концентрация электролита.
При перемещении центрального иона проходит какое-то время, пока старая ионная атмосфера разрушится и возникнет новая. Поэтому позади иона будет всегда находиться некоторый избыток заряда противоположного знака, и возникающие электрические силы притяжения будут тормозить его движение. Этот эффект торможения называется релаксационным. Если изменение эквивалентной электропроводности, связанное с релаксационным эффектом, обозначить через λ II , то уменьшение электропроводности при переходе от нулевой концентрации (идеальный раствор) к концентрации с дается уравнением
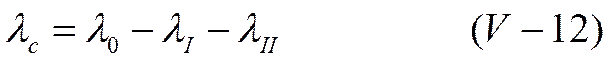
в котором учитываются и электрофоретический, и релаксационный эффекты.
Дебай и Гюккель вывели теоретические формулы для λ I и λ II , в которые входит одна эмпирическая константа. Их расчеты были улучшены в дальнейшем Онзагером. Последний принял во внимание то обстоятельство, что движение ионов не совершается по прямой, а ионная атмосфера представляет собой статистическое образование. Уравнение Онзагера имеет следующий вид:
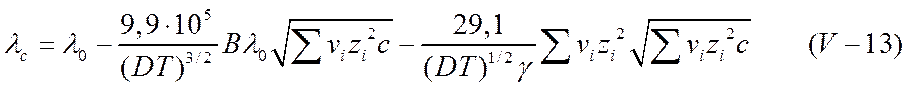
где
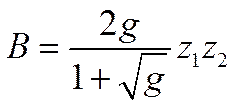
a
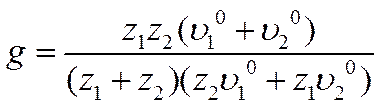
и γ - вязкость растворителя.
Для водных растворов 1-1 валентных электролитов при 25° С уравнение (IV-13) принимает вид
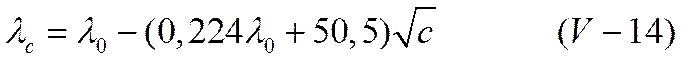
Уравнения (IV-13) и (IV-14) совпадают по виду с эмпирическим законом квадратного корня Кольрауша (Закон кубического корня, применимый в области умеренных концентраций, не вытекает из теории Онзагера, но его можно получить как следствие теории Гхоша). Они позволяют теоретически предсказать численное значение константы А уравнения Кольрауша.
Формула Онзагера согласуется с опытными данными в той области концентраций, где приложим закон квадратного корня. При увеличении концентрации сходимость с опытом ухудшается. Уравнение Онзагера следует рассматривать как эквивалент первого приближения теории Дебая и Гюккеля применительно к явлениям электропроводности. Оно дает поэтому лишь предельное ее значение при концентрации электролита, приближающейся к нулю, т. е. касательную к кривой зависимости электропроводности от концентрации. Подобно тому, как это было сделано во втором приближении теории Дебая и Гюккеля при рассмотрении равновесия в растворах электролитов, можно было бы попытаться учесть влияние конечных размеров ионов и ввести параметр α в уравнения для электропроводности. Такие попытки были сделаны Канеко (1932), Фалькенгагеном (1952), Онзагером и Фуоссом (1955) и др. Питc (1953), следуя Ла Меру, учел, кроме того, дополнительные члены разложения в ряд показательной функции (см. стр. 53), а Робинсон и Стоке (1955) —изменение вязкости раствора с концентрацией. Введение среднего диаметра ионов а, являющегося эмпирической константой, и использование экспериментального значения вязкости позволили получить лучшую сходимость с опытом и распространить видоизмененное таким образом уравнение Онзагера на электропроводность более концентрированных растворов. Однако уравнения, полученные при этом, настолько сложны, что практическая их ценность становится иллюзорной. Так, например, в уравнении Онзагера и Фуосса
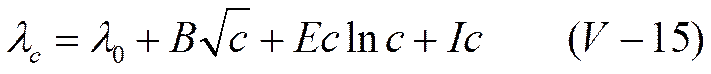
появляется логарифмический член и наряду с константой Е, которая определяется теми же параметрами, что и константа В первоначального уравнения Онзагера, входит величина I, зависящая от размера ионов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.