Так как энергия отрыва протона от гидроксильного остатка ОН- в молекуле воды больше, чем энергия отрыва Н+ от молекулы воды в гидроксониевом ионе, то и вероятность таких перескоков должна быть меньше, и скорость движения гидроксильных ионов ниже, чем водородных. Неблагоприятная ориентация образовавшейся молекулы воды здесь также увеличивает пространственные затруднения для следующего перескока протона, в результате чего скорость движения гидроксильных ионов снижается.
Аномальная электропроводность в неводных растворах электролитов
Для водных растворов большинства электролитов изменение эквивалентной (или молекулярной) электропроводности с разбавлением выражается плавной кривой (см. рис. 12). Электропроводность электролита растет по мере разбавления, стремясь в пределе к значению проводимости при бесконечном разбавлении. Совершенно иной ход кривой молекулярная электропроводность — разведение (λ — V] обнаружил в I890 г. Каблуков при изучении свойств растворов хлористого водорода в амиловом спирте. Он установил, что в определенной области концентраций проводимость раствора не растет, а уменьшается с разведением. Эти исследования были продолжены затем многими учеными, подтвердившими его наблюдения. Оказалось, что когда применяются растворители с низкой диэлектрической постоянной, то вместо обычной для водных растворов монотонной кривой электропроводность — разбавление получаются кривые с минимумом, за которым следует плавный подъем. Иногда на кривых λ — У или λ — с можно обнаружить и максимум, и минимум, т. е. здесь зависимость электропроводности от концентрации сложнее, чем в водных растворах.
Изменение молекулярной (или эквивалентной) электропроводности с разведением, характеризующееся появлением экстремумов на кривой λ — V, отвечает «аномальной электропроводности». Это явление наблюдалось Н. С. Сахановым для растворов нитрата серебра в некоторых неводных индивидуальных и смешанных растворителях с низкими диэлектрическими постоянными. П. И. Валь-ден, впервые применивший в качестве электролита тетразамещенные соли аммония (гак называемые «вальденовские соли»), обладающие хорошей растворимостью в большинстве неводных растворителях, подтвердил эти наблюдения. Фоус и Краус детально изучили аномальную электропроводность в растворителях, состоящих из смеси диоксана с водой. Саханов обратил внимание также на то, что в концентрированных растворах измеряемая величина электропроводности включает в себя эффект вязкости. В этой связи он ввел понятие о коррегированной электропроводности λ k, т. е. о величине эквивалентной электропроводности, в которой учтено увеличение вязкости при данном разбавлении γ, по сравнению с вязкостью при бесконечном разбавлении γ∞

Коррегированная электропроводность более чувствительна к изменению состава раствора, чем обычная величина электропроводности, не исправленная на вязкость. При сравнительном изучении электропроводности электролитов в разных растворителях следует учитывать влияние на нее вязкости среды.
Ни классическая теория электропроводности, ни современная теория Дебая — Онзагера не могут служить основой для истолкования явления аномальной электропроводности. Учет явления сольватации также не дает возможности получить кривые эквивалентная электропроводность — разведение (λ — V) с экстремумами. Впервые теория аномальной электропроводности была сформулирована в 1913—1916 гг. Сахановым на основе представлений об ассоциации электролитов, которая наиболее отчетливо проявляется в растворителях с низкой диэлектрической постоянной и приводит к появлению комплексных молекулярных и ионных соединений. По Саханову, в концентрированных растворах, кроме молекул электролита МА, имеются ассоциированные молекулы (МА)X, находящиеся в равновесии с простыми молекулами
xMA=(МА)X (V-25)
Ассоциированные молекулы способны распадаться на комплексные ионы—переносчики тока в данных условиях
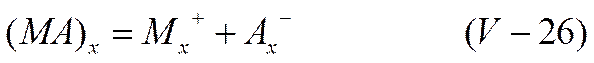
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.