Методом кондуктометрии нельзя, однако, воспользоваться при определении какого-либо одного сорта ионов на фоне других электролитов. Обладая собственной электропроводностью, они будут маскировать изменение проводимости, отвечающее изменению концентрации определяемого сорта ионов в ходе кондуктометрического титрования, что, естественно, должно снижать точность метода и ограничивать область его применения.
Высокочастотная кондуктометрия
В последние годы все большее распространение получает так называемая высокочастотная кондуктометрия. В этом случае применяются переменные токи с частотами порядка нескольких миллионов герц. При таких высоких частотах электроды можно вывести из раствора за пределы ячейки (в которой проводятся измерения), что позволяет избежать многих осложнений, связанных с обычной кондуктометрией, а именно: каталитического действия электродов на реакции в растворах, изменения поверхности электродов в ходе измерений, необходимости применения электродов из материала, стойкого по отношению к раствору, и т. п.
При высокочастотной кондуктометрии измерительная ячейка, изготовленная из стекла или пластмассы и содержащая испытуемый раствор, помещается между двумя металлическими пластинами, плотно примыкающими к стенкам ячейки (ячейка конденсаторного типа) или во внутрь индукционной катушки (ячейка индукционного типа). При высокочастотной кондуктометрии измеряется не электропроводность раствора, а совокупность многих свойств раствора я ячейки, включая и диэлектрическую постоянную. Поэтому интерпретация полученных результатов здесь более сложна, по сравнению с обычной кондуктометрией.
Этот метод успешно применяется для анализа и при проведении научных исследований.
ТЕОРЕТИЧЕСКАЯ ИНТЕРПРЕТАЦИЯ ЭЛЕКТРОПРОВОДНОСТИ ЭЛЕКТРОЛИТОВ
Зависимость удельной электропроводности от концентрации выражается кривой с максимумом (см. рис. 10). Чтобы объяснить появление максимума, классическая теория использует уравнение
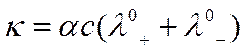
При этом полагают, что слагаемое в скобках не зависит от концентрации, а степень электролитической диссоциации уменьшается с ее ростом. Поэтому при определенной концентрации произведение α с, а следовательно, и κ будет иметь наибольшее значение.
В рамках
классической теории это объяснение не соответствует действительности. Известно,
что степень диссоциации электролита α и его концентрация
с связаны между собой уравнением 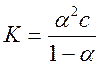 , откуда
, откуда
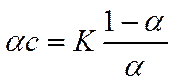
Из последнего уравнения следует, что при увеличении концентрации произведение α с тоже должно закономерно увеличиваться, так как отношение (1- α)/α будет непрерывно расти. Поэтому нельзя ожидать появления какого-либо экстремума на кривой удельная электропроводность —концентрация (k —с). Следовательно, классическая теория электропроводности не может даже качественно объяснить характер зависимости удельной электропроводности от концентрации. По классической теории для эквивалентной электропроводности, как функции состава раствора должно оправдываться уравнение
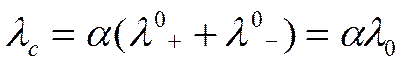
При разбавлении степень диссоциации электролита растет, приближаясь к единице, и эквивалентная электропроводность также должна стремиться к некоторому пределу, равному λ 0. Таким образом, общий ход кривой эквивалентная электропроводность — концентрация (λ —с) можно качественно истолковать с позиций классической теории. Используя закон разведения Оствальда
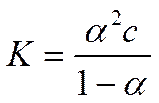
и учитывая, что α = λ c/λ 0, получаем при а<< 1
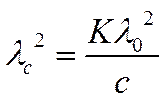
или
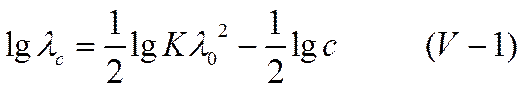
Выражение (V-l) совпадает по форме с эмпирическим уравнением (IV-53), справедливым для слабых электролитов. Однако бесполезно пытаться получить по классической теории уравнение, подобное эмпирическому закону квадратного корня Кольрауша, справедливому для растворов сильных электролитов. Классическая теория электропроводности, основанная на теории электролитической диссоциации Аррениуса, не в состоянии истолковать ни изменения чисел переноса и ионных подвижностей с концентрацией, ни близости температурных коэффициентов электропроводности и вязкости, ни аномальных подвижностей ионов водорода и гидроксила. Растворы электролитов (в отличие от допущений теории Аррениуса) нельзя принимать за идеальные системы ни в состоянии равновесия, ни при прохождении через них электрического тока.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.