λ I*=0, λ II *=0 и λ c=λ 0
Влияние напряженности поля на электропроводность слабых электролитов (у которых вследствие низкой концентрации свободных ионов силы взаимодействия близки к нулю) должно быть связано с изменением степени электролитической диссоциации под действием приложенного поля. Онзагер, основываясь на таком предположении, разработал качественную и количественную теорию этого явления. Он показал, что скорость диссоциации слабых электролитов увеличивается с напряженностью поля, а скорость рекомбинации ионов от нее не зависит; в результате степень диссоциации должна расти. Относительное увеличение константы диссоциации, рассчитанное Онзагером на основании его теории, хорошо согласуется с опытными наблюдениями Вина.
Вскоре после открытия Вина, Дебай и Фалькенгаген теоретически предсказали существование еще одного эффекта. Сущность его заключается в увеличении электропроводности растворов электролитов с частотой приложенного электрического поля. Этот эффект называется эффектом Дебая — Фалькенгагена или дисперсией электропроводности. Возможность его появления также обусловлена существованием ионной атмосферы. Действительно, при высоких частотах ионы в растворе не перемещаются, а лишь совершают колебательные движения в направлении, параллельном направлению поля. Центральный ион при этом не успевает выйти за пределы ионной атмосферы, которая также не успевает заметно разрушиться, а в каждый данный момент только колеблется в направлении, обратном движению центрального иона. В этом случае силы, связанные с разрушением и с созданием ионной атмосферы, т. е. релаксационные тормозящие силы, проявляются в меньшей степени и электропроводность раствора растет. При высоких частотах она достигает значения, которое отличается от электропроводности при бесконечном разведении на величину λ*I, поскольку релаксационный эффект исчезнет λ*II = 0, а электрофоретическое торможение сохранится. В этом случае
λ c=λ 0 – λ*I
Вин экспериментально проверил расчеты Дебая и Фалькенгагена и показал их хорошую сходимость с опытом.
АНОМАЛИИ ЭЛЕКТРОПРОВОДНОСТИ.
Аномальная подвижность ионов водорода и гидроксила
Аномальная подвижность ионов водорода и гидроксила, значительно превышающая подвижность всех других ионов, заставляет предполагать, что движение этих ионов в водных растворах подчинено особому механизму. Современная теория аномальной подвижности водородных и гидроксильных ионов, разработанная Берналом и Фаулером, представляет собой развитие идеи о механизме электропроводности электролитов, высказанной русским ученым Гротгусом еще в самом начале прошлого века.
Поскольку большая часть энергии гидратации протона освобождается , когда он соединяется с первой молекулой воды, считается, что ион водорода в водных растворах должен присутствовать в виде иона гидроксония Н3О+. Протон может переходить от одной молекулы роды к другой, соседней. Эти переходы связаны с некоторой энергией активации. В отсутствие внешнего поля перескоки протона равновероятны для любого направления. При наложении поля вероятность перескока в направлении поля повышается (так как энергия активации в этом направлении понижается), и процесс передвижения протона будет совершаться по цепочке, в согласии с так называемым «эстафетным» механизмом, когда протон как эстафета передается от одной молекулы воды к другой направление поля —>
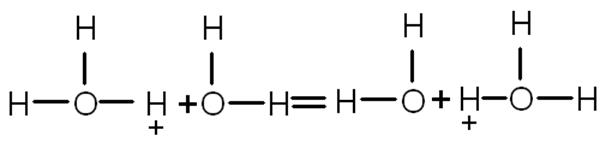
направление движения протона —>
Как следует из схемы, молекула воды, оставшаяся после ухода протона из гидроксониевого иона, оказывается ориентированной неблагоприятно для следующего перескока, что снижает скорость движения протона, которая в противном случае была бы еще более высокой.
Аномальную подвижность гидроксониевого иона можно представить аналогичной цепочкой.
направление поля —>
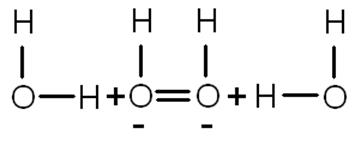
направление движения иона гидроксила <—
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.