Для концентрированных растворов пользуются эмпирическими формулами. Одной из лучших следует признать формулу Шидловского
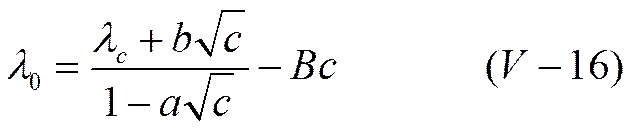
где В — некоторый эмпирический коэффициент. Первый член правой части уравнения (V-16) отвечает формуле Онзагера (V-13), которую можно написать как
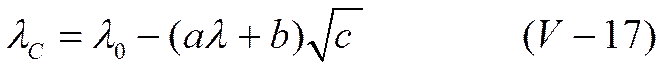
или
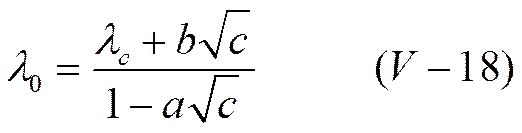
Эффект Вина и дисперсия электропроводности
Вин (1928) нашел, что при кратковременных импульсах тока электропроводность раствора растет с напряженностью поля. Вначале она увеличивается медленно, затем, при больших полях, быстрее и, наконец, при еще более высоких полях достигает некоторого предела. Независимо от концентрации раствора, для каждого данного электролита этот предел отвечает его электропроводности при нулевой концентрации. В случае слабых электролитов Вин обнаружил еще более явно выраженный рост электропроводности с увеличением напряжения, установив, что чем меньше степень диссоциации электролита, тем заметнее увеличивается его электропроводности, стремясь к электропроводности при нулевой концентрации,
Результаты, полученные Вином, казались вначале совершенно невероятными. Они противоречили общепринятому представлению о приложимости закона Ома к растворам электролитов. Действительно, по закону Ома
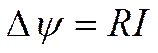
сопротивление R (или обратная ему величина электропроводности) для данной системы является неизменной величиной и, следовательно, напряженность поля должна зависеть линейно от силы тока. Из опытов же Вина следовало, что при высоких значениях Δψ величина сопротивления R перестает быть постоянной и начинает падать с напряженностью поля. Следовательно, напряженность поля увеличивается непропорционально силе тока, и закон Ома в этом случае уже не оправдывается. Были высказаны предположения, согласно которым эффект Вина является результатом каких-то неучтенных, вторичных явлений. Предполагалось, например, что падение сопротивления при высоких полях связано с разогревом электролита. Однако и расчеты, и дополнительные исследования, поставленные по усовершенствованной методике с использованием кратковременных импульсов тока (при которых повышение температуры исключалось), подтвердили сделанное Вином наблюдение о влиянии напряженности поля на электропроводность электролитов.
Применительно к сильным электролитам эффект Вина можно объяснить на основе теории электропроводности Дебая —Онзагера. Согласно представлениям Дебая и Гюккеля, в растворе каждый ион окружен ионной атмосферой с радиусом l/χ. Пока скорость его движения мала (по сравнению со скоростью разрушения и образования ионной атмосферы), тормозящие эффекты, связанные с ионной атмосферой, сохраняются, и величина электропроводности при данной концентрации равна
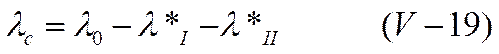
Однако, как известно, скорость ионов при увеличении напряженности поля не остается постоянной, а растет в соответствии с уравнением (IV-10)
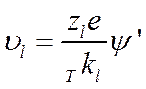
При достаточно высоком значении ψ' может оказаться, что путь, пройденный ионом за время разрушения старой и образования новой ионной атмосферы, т. е. за удвоенное время релаксации τr, будет равен или больше радиуса ионной атмосферы
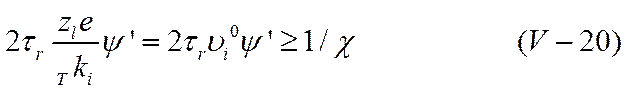
В этих условиях ион выйдет за пределы ионной атмосферы. Ионная атмосфера не будет успевать образовываться в каждом новом месте нахождения иона и, следовательно, ее суммарный тормозящий эффект уменьшится. При помощи уравнения (V-20) можно приближенно оценить ту напряженность поля, при которой начнет проявляться эффект Вина. Используя уравнение (V-10)

для времени релаксации и подставляя его в выражение (V-20), получим для искомой напряженности поля
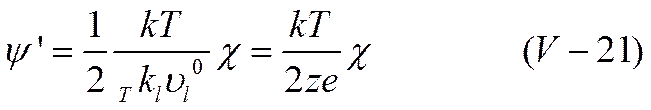
В случае 1-1 валентного электролита при комнатной температуре уравнение (V-11) упрощается до
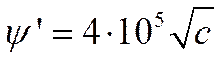
Таким образом для 0,001 н. раствора 1-1 валентного электролита эффект Вина начнет проявляться при полях порядка 104, а для 1 н. — при 4-105 в/см.
Дальнейшее повышение напряженности поля приведет к такой скорости движения ионов, при которой ионная атмосфера вообще не будет успевать образовываться. Исчезнут все связанные с ней тормозящие эффекты. Не будет наблюдаться изменения электропроводности ни за счет электрофоретического эффекта, ни за счет релаксационного. В этом случае
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.