Если внешние условия изменяются (р или Т, или р и Т одновременно), то точка, соответствующая этим условиям, перемещается на диаграмме (например, нагревание или охлаждение при постоянном давлении соответствует перемещению точки по горизонтальной прямой). Когда точка на диаграмме переходит из одной области в другую, происходит переход вещества из одного состояния в другое. Так, при переходе через линию ВС происходит плавление или кристаллизация, через КС - испарение или конденсация, через АС - сублимация или де сублимация. Поэтому линии равновесия фаз ВС, КС и АС называют еще линиями фазовых переходов, а диаграмму состояний диаграммой фазовых переходов.
Напомним, что фазовые превращения связаны с изменением внутренней энергии вещества и происходят с поглощением (или выделением) теплоты фазового превращения – теплоты плавления (кристаллизации), парообразования (конденсации), сублимации (де сублимации).
На диаграмме состояний (рисунок 36) видно, что сублимация и десублимация, возможны при температурах и давлениях меньших, чем в тройной точке. Так, лед может возгоняться только при температуре ниже 273,16 К, когда давление водяных паров над поверхностью льда меньше давления насыщенного водяного пара.
Углекислота в тройной точке имеет температуру, равную -5б,б°С , и давление 5,11 атм. Поэтому при атмосферном давлении углекислота может существовать только в твердом или газообразном состоянии и «сухой лед» превращается непосредственно в газ; при нормальном давлении температура его сублимации равна -78°С.
Температура и давление в тройной точке для различных веществ различны. Поэтому в большинстве случаев при обычных условиях сублимации не наблюдают.
Оказывается, что температура в тройной точке для раствора всегда меньше, чем для чистого растворителя.
Линия СВ в большинстве случаев немного отклонена от вертикали вправо от точки С, а для льда, висмута, галлия, германия, кремния - влево. У воды в точке С р=610 Па (4,58 мм рт. ст.) и Т= 273,16 К (т.е. 0,01°С), а при нормальном давлении (р=1,013-105 Па, или 760 мм рт. ст.) температура плавления льда равна 273,15К (0°С).
Заметим, что в неустойчивом состоянии жидкость может находиться в области пара (перегретая жидкость) или в области твердой фазы (переохлажденная жидкость). Пересыщенный пар тоже может оказаться в области жидкости или в области твердого состояния. Однако твердая фаза всегда переходит в жидкую или газообразную на кривой АСВ. Таким образом, перегретых кристаллов в природе не бывает.
 Важные
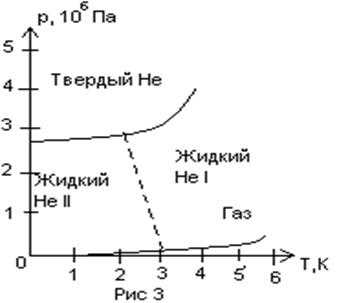
особенности имеет диаграмма состояний гелия (рисунок 37). На этой диаграмме
видно, что линии равновесия твердой фазы с жидкой и жидкой фазы с газообразной
нигде не пересекаются, т.е. у гелия нет тройной точки. Другие вещества с
такой особенностью неизвестны.
Важные
особенности имеет диаграмма состояний гелия (рисунок 37). На этой диаграмме
видно, что линии равновесия твердой фазы с жидкой и жидкой фазы с газообразной
нигде не пересекаются, т.е. у гелия нет тройной точки. Другие вещества с
такой особенностью неизвестны.
 Критическая температура гелия равна 5,25К.
Следовательно, гелий можно перевести в жидкое состояние, только охладив его
ниже этой температуры. Опыты, выполненные П.Л.Капицей, показали, что при
небольших давлениях гелий остается в жидком состояния даже при температуре, как
угодно близкой абсолютному нулю. Все другие вещества
переходят в твердое состояние при значительно
более высоких температурах. Гелий же переходит в твердое состояние лишь под давлением в несколько десятков атмосфер (рисунок
37). Линия сублимации у гелия отсутствует, т.е. твердый гелий ни при каких условиях не может быть в равновесии со
своим паром.
Критическая температура гелия равна 5,25К.
Следовательно, гелий можно перевести в жидкое состояние, только охладив его
ниже этой температуры. Опыты, выполненные П.Л.Капицей, показали, что при
небольших давлениях гелий остается в жидком состояния даже при температуре, как
угодно близкой абсолютному нулю. Все другие вещества
переходят в твердое состояние при значительно
более высоких температурах. Гелий же переходит в твердое состояние лишь под давлением в несколько десятков атмосфер (рисунок
37). Линия сублимации у гелия отсутствует, т.е. твердый гелий ни при каких условиях не может быть в равновесии со
своим паром.
Жидкий гелий обладает важной особенностью. При температурах выше 2,19 К он обладает обычными для сжиженных газов свойствами и называется гелий-I. Когда гелий, находящийся под давлением его насыщенных паров, охлаждают ниже температуры 2,19 К, происходит резкое изменение его свойств, и он (оставаясь жидким) переходит в новое состояние, в котором его называют гелий-II. В этом состоянии гелий является как бы смесью двух жидкостей, одна из которых - обычный гелий-I, .а другая представляет собой сверхтекучую компоненту, абсолютно лишенную вязкости. Эти две компоненты могут свободно двигаться одна внутри другой без взаимодействия между собой. Сверхтекучая компонента без всякого трения протекает через самые узкие капилляры и щели.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.