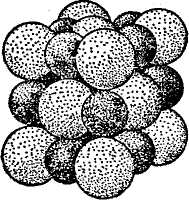
На рисунке 24 изображен скелет кристаллической решетки твердой двуокиси углерода СО2, («сухого льда»), в узлах которой показаны молекулы СО2. Однако в действительности молекулы СО2 внутри кристалла располагаются вплотную, подобно шарам при плотной упаковке, как показано на рис. (вверху изображена молекула СО2,). Это в полной мере относится и к кристаллам других веществ.
Опыт показал, что идеального дальнего порядка в расположении частиц твердого вещества на практике никогда не получается.
 Любые отступления от идеального порядка в кристалле
называют дефектами пространственной решетки. Одним из важнейших дефектов
решетки является нарушение правильного расположения
Любые отступления от идеального порядка в кристалле
называют дефектами пространственной решетки. Одним из важнейших дефектов
решетки является нарушение правильного расположения
Рисунок 24 - Модель кристаллической решетки двуокиси углерода
Рисунок 25 – Схема расположения молекул СО2 в кристаллической решетки двуокиси углерода
частиц кристалла в: каждый момент времени, обусловленное тепловым движением этих частиц. Действительно, поскольку частицы непрерывно движутся, узлы определяют лишь среднее положение каждой частицы.
Еще одним важным дефектом является нарушение в строении самой решетки, называемое дислокацией (рисунок 26).
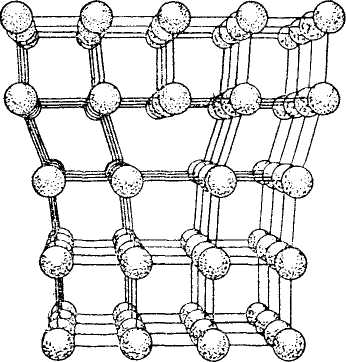
![]()

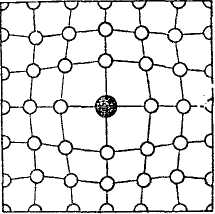
Часто встречающимся видом дефекта кристаллической решетки является внедрение чужеродных атомов или молекул в отдельные узлы решетки (рисунок 27).
Не менее часто встречается дефект, заключающийся в отсутствии частиц в отдельных узлах решетки, который в основном обусловливает возможность диффузии в твердых телах.
Этими примерами не ограничиваются виды дефектов пространственных решеток.
Дефекты решетки в кристаллах сильно влияют на многие свойства твердых тел, например на прочность, пластичность, электропроводность и т.д.
Виды кристаллических структур
Различные типы кристаллов их возможное расположение узлов в пространственной решетке изучает кристаллография. В физике кристаллические структуры рассматривают не с точки зрения их геометрии, а по характеру сил, действующих между частицами кристалла, т. е. по типу связей между частицами.
• Na+ o Cl-
 |
Между частицами, находящимися в узлах решетки кристалла, различают четыре типичные кристаллические структуры: ионную, атомную, молекулярную и металлическую. Выясним, в чем заключается сущность различия между этими структурами.
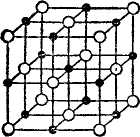
Ионная кристаллическая структура характеризуется наличием положительных и отрицательных ионов в узлах решетки. Силами, которые удерживают ионы в узлах такой решетки, являются силы электрического притяжения и отталкивания между этими ионами.
На рисунке 28, а изображены центры ионов в узлах решетки хлористого натрия (поваренной соли), а на рисунке 28,б—упаковка ионов Na+ и С1~ в такой решетке.
Разноименно заряженные ионы, в ионной решетке расположены ближе друг к другу, чем одноименно заряженные, поэтому силы притяжения между ионами решетки преобладают над силами отталкивания. Этим и обусловливается значительная прочность кристаллов с ионной решеткой.
При плавлении веществ с ионной кристаллической решеткой из узлов решетки в расплав переходят ионы, которые становятся свободными носителями зарядов. Поэтому такие расплавы являются хорошими проводниками электрического тока. Это справедливо и для растворов кристаллических веществ с ионной решеткой. Например, раствор поваренной соли в воде является очень хорошим проводником электрического тока.
Атом н а я кристаллическая структура характеризуется наличием нейтральных атомов в узлах решетки, между которыми имеется ковалентная связь. Ковалентной называется такая связь, при которой каждые два соседних атома удерживаются рядом силами притяжения, возникающими при взаимном обмене двумя валентными электронами между этими атомами.

Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.