Если тяжелый атом обладает значительной электронной плотностью, то происходит существенное изменение рентгенограммы (рис. 2.7). Различие интенсивностей рефлексов на дифракционных картинах нативного белка и его производных можно использовать для решения фазовой проблемы, если известно положение присоединенного тяжелого атома. Если кристалл является центросимметричным (т.е. каждому атому в положении x, y, zотвечает атом в положении -x, -y, -z), то для однозначного определения фаз требуется одно тяжелоатомное производное. В случае нецентросимметричных кристаллов белка нужно использовать несколько тяжелоатомных производных, так как одно такое производное не позволяет определить все фазы отражений. В этом случае говорят о так называемом многократном изоморфном замещении.
|
|
Рис. 2.7. Рентгенограммы кристаллов нативного белка фосфорилазы (а)
и тяжелоатомной производной этого белка – этилмеркуртиосалицилата фосфорилазы (б)
В методе изоморфного замещения можно условно выделить пять стадий.
1. Получение тяжелоатомных производных.
2. Измерение интенсивностей рефлексов рентгенограмм нативного белка и его тяжелоатомных производных.
3. Обработка данных и внесение поправок в интенсивности рефлексов.
4. Определение положения тяжелых атомов.
5. Определение фаз.
Далее рассмотрим основные положения теории метода изоморфного замещения.
Обозначим через ![]() структурный фактор нативного белка,
который является вектором и характеризуется структурной амплитудой FР и фазой
структурный фактор нативного белка,
который является вектором и характеризуется структурной амплитудой FР и фазой ![]() .
Аналогично для тяжелоатомного производного вектор
.
Аналогично для тяжелоатомного производного вектор ![]() - структурный фактор, имеющий
амплитуду FPH и фазу
- структурный фактор, имеющий
амплитуду FPH и фазу ![]() .
Векторы
.
Векторы ![]() и
и ![]() связаны
между собой следующим соотношением:
связаны
между собой следующим соотношением:
![]() ,
(2.17)
,
(2.17)
где вектор ![]() характеризует
вклад тяжелых атомов в структурный фактор тяжелоатомного производного (рис.
2.8).
характеризует
вклад тяжелых атомов в структурный фактор тяжелоатомного производного (рис.
2.8).
|
|
Рис. 2.8. Векторная диаграмма, показывающая вклады
нативного белка (![]() )
и тяжелого атома
)
и тяжелого атома ![]() в структурный фактор
в структурный фактор
тяжелоатомного производного белка ![]()
Зная величины структурных
амплитуд FPH и FP (их можно измерить), а также
расположение тяжелых атомов в элементарной ячейке, можно найти вектор ![]() и затем - фазу
и затем - фазу ![]() .
Она определяется следующим соотношением:
.
Она определяется следующим соотношением:
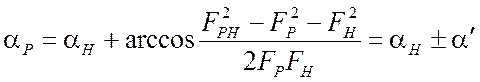 ,
(2.18)
,
(2.18)
которое можно получить, используя
теорему косинусов из рис. 2.9. Указанное соотношение свидетельствует о том, что
имеется два возможных значения ![]() , которые в случае
одного изоморфного производного нельзя различить. Неопределенность устраняется
только в том случае, если векторы
, которые в случае
одного изоморфного производного нельзя различить. Неопределенность устраняется
только в том случае, если векторы ![]() и
и ![]() коллинеарны.
коллинеарны.
|
|
Рис. 2.9. Схема, характеризующая структурные амплитуды и фазы,
используемые в тексте
Указанную
неопределенность можно проиллюстрировать графически, если использовать
построение, показанное на рис. 2.10, которое предложил Харкер. Из центра О
проводят вектор -![]() . Затем строят окружность
радиусом FPH с центром J в конце вектора -
. Затем строят окружность
радиусом FPH с центром J в конце вектора -![]() .
Вторая окружность радиусом FP имеет своим центром точку О. В общем случае имеются
две точки пересечения этих окружностей G и H.
Отрезки OG и OH соответствуют двум возможным положениям вектора
.
Вторая окружность радиусом FP имеет своим центром точку О. В общем случае имеются
две точки пересечения этих окружностей G и H.
Отрезки OG и OH соответствуют двум возможным положениям вектора ![]() . Они расположены симметрично
относительно вектора
. Они расположены симметрично
относительно вектора ![]() . Если векторы
. Если векторы ![]() и
и ![]() коллинеарны,
то имеется только одна точка, в которой окружности касаются, и решение однозначно.
коллинеарны,
то имеется только одна точка, в которой окружности касаются, и решение однозначно.
|
|
Рис. 2.10. Построение Харкера для расчета фаз методом
одного изоморфного замещения, которое соответствует рис. 2.9
Отметим, однако, что метод однократного изоморфного замещения применим к нецентросимметричным структурам, если тяжелые атомы не находятся в частных положениях или не связаны центрами симметрии. Этим методом можно получить карту электронной плотности белка, но из-за высокого уровня фона он редко используется в кристаллографии белка.
Обычно положения тяжелых
атомов неизвестны, т.е. вектор ![]() нельзя построить.
Однако структурные амплитуды FPH и FP позволяют оценить величину FH. Можно показать, используя рис. 2.9,
что если величина FH мала по сравнению с величинами FPH и FP, то имеет место приближенное
соотношение
нельзя построить.
Однако структурные амплитуды FPH и FP позволяют оценить величину FH. Можно показать, используя рис. 2.9,
что если величина FH мала по сравнению с величинами FPH и FP, то имеет место приближенное
соотношение
![]() .
(2.19)
.
(2.19)
Когда векторы ![]() и
и ![]() коллинеарны,
то
коллинеарны,
то ![]() . Если же структурная амплитуда FH будет большой, то может иметь место
следующее соотношение:
. Если же структурная амплитуда FH будет большой, то может иметь место
следующее соотношение: ![]() .
.
После оценки величины FH ее значение используют для определения положений тяжелых атомов. Для приближенного определения этих положений используется метод Паттерсона, а для уточнения положений - разностные синтезы Фурье.
В первом методе
используется функция Паттерсона, которая является преобразованием Фурье
интенсивности ![]() рассеянного излучения,
получаемой из эксперимента:
рассеянного излучения,
получаемой из эксперимента:
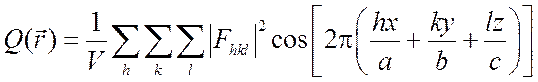 .
(2.20)
.
(2.20)
Максимумы функции Паттерсона
приблизительно пропорциональны произведению атомных номеров zizj и, если расстояния rij повторяются в структуре, числу этих
повторений. Для тяжелого атома величина zi велика и поэтому будет большим
соответствующий максимум функции Паттерсона. Эта функция позволяет определять
структуру относительно простых соединений. В случае сложных структур белков
вероятность обнаружений каких-либо деталей структуры очень мала. Тем не менее,
правильная интерпретация функции Паттерсона очень важна в кристаллографии белка,
так как функция ![]() содержит структурную
информацию. В связи с этим метод Паттерсона составляет основу локализации
тяжелых атомов в тяжелоатомных производных кристаллов белков.
содержит структурную
информацию. В связи с этим метод Паттерсона составляет основу локализации
тяжелых атомов в тяжелоатомных производных кристаллов белков.
Разностные синтезы Фурье используются для определения координат тяжелых атомов, если из изучения других тяжелоатомных производных известны оценки фаз белка. В качестве коэффициентов в этих синтезах используются следующие выражения:
![]() ,
(2.21)
,
(2.21)
которые характеризуют векторный вклад
тяжелого атома в направлении структурного фактора белка, заданного фазой ![]() . Величина m называется показателем достоверности
и используется в качестве веса. Она теоретически представляет среднее значение
косинуса погрешности фазового угла и равна 1 для ошибки фазового угла, равной
0. Если же ошибка равна примерно 420, то m=0,74, а в случае ошибки в 760 - m=0,24.
. Величина m называется показателем достоверности
и используется в качестве веса. Она теоретически представляет среднее значение
косинуса погрешности фазового угла и равна 1 для ошибки фазового угла, равной
0. Если же ошибка равна примерно 420, то m=0,74, а в случае ошибки в 760 - m=0,24.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.