5. Расчет погрешностей в лабораторных работах физического практикума. Методические указания к вводным занятиям в физическом практикуме / Н.А.Гринчар, Ф.П.Денисов, Б.А.Курбатов, В.А.Никитенко, А.П.Прунцев; Под общ. ред. Ф.П.Денисова. - М.: МИИТ, 1995. - с. 32.
6. Методические указания к лабораторным работам по физике. Работы 60-63. Ошибки измерения физических величин. - М.: Изд. МИИТ, 1976. - с. 10 - 11.
РАБОТА №11
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ГАЗА
МЕТОДОМ КЛЕМАНА - ДЕЗОРМА
Цель работы. Определение величины отношения теплоемкости воздуха при постоянном давлении к теплоемкости при постоянном объеме.
Приборы и принадлежности. Стеклянный (или металлический) баллон, водяной манометр, насос (ручной или электрический в металлическом баллоне).
Введение
Первый закон термодинамики утверждает, что количество теплоты DQ, сообщенное газу, расходуется на изменение внутренней энергии газа DU и на работу А, совершаемую газом:
DQ = DU + A.
Теплоемкостью газаназывается величина равная количеству теплоты, необходимой для нагревания данной массы газа на один кельвин.
С= lim DQ/DT = dQ/dT.
DT®0
Теплоемкость единицы массы газа называется удельной теплоем-костью. Теплоемкость одного моля называется молярной теплоемкостью.
Приращение внутренней энергии идеального газа DU, при изменении температуры DТ, определяется выражением:
DU = m /m´ i /2 ´ R DT,
где i - число степеней свободы, т.е. число независимых параметров определяющих положение и ориентацию молекулы в пространстве, m- молярная масса газа. Число степеней свободы можно вычислить по формуле
i = 3N - К,
где N – количество атомов образующих молекулу, а К – число жестких связей между этими атомами.
При постоянном объеме А = 0. В этом случае DQ = DU. Теплоемкость газа при постоянном объеме
Cv= 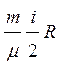 .
.
Работа газа при постоянном давлении
A = p ´ DV = m /m´ R DT.
Таким образом, теплоемкость газа при постоянном давлении
Cp= m /m´ (i /2 ´ R + R).
Отношение теплоемкостей для данной массы идеального газа зависит от числа атомов в молекуле и определяется числом степеней свободы.
g= Cp / Cv = ( i + 2) / i . (1)
Приведенная формула верна и для смеси идеальных газов с одинаковым числом степеней свободы.
Методика измерений и описание установки
Для определения отношения Сp / Cv в случае воздуха в данной лабораторной работе применен метод, предложенный Клеманом и Дезормом, в котором использовано охлаждение газа при его адиабатическом расширении. Предполагается, что воздух идеальный газ.
Напомним, что адиабатическим называется процесс, который происходит без теплообмена с окружающей средой. Быстрое сжатие и быстрое расширение газа приблизительно можно рассматривать как адиабатический процесс.
Запишем первый закон термодинамики для адиабатического процесса
0 =DU + A. (2)
Отсюда видно, что при адиабатическом расширении температура газа понижается, так как часть внутренней энергии газа расходуется на работу по расширению газа. Перепишем (2) в виде:
∆U = Â, (3)
где Â = -A, работа, совершаемая над газом внешними силами. Из (3) следует, что при адиабатическом сжатии газа температура газа повышается за счет работы внешних сил.
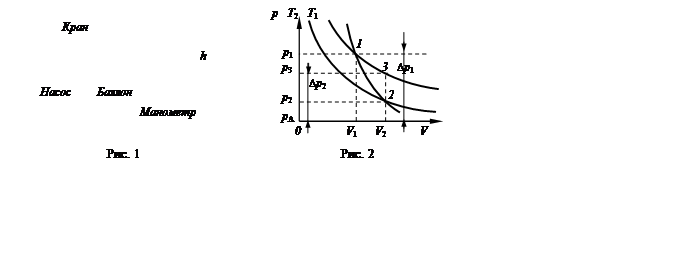

Лабораторный стенд состоит из насоса и баллона, наполненного воздухом и соединенного с водяным манометром (рис. 1). Посредством крана баллон может сообщаться с атмосферой. Первоначально в баллоне было атмосферное давление pA и температура ТB, равная температуре окружающей среды.
С помощью насоса можно подкачать в баллон некоторое количество воздуха, в результате чего давление в баллоне повысится. В стеклянный баллон воздух подаётся ручным насосом, в металлический – электрическим (выключатель Н размещён на стенде). Перед включением насоса кран на баллоне следует открыть; после достижения необходимого значения высоты h столбика воды в манометре (но не больше, чем 40см!) насос выключают, а кран закрывают.
При работе на установке с ручным насосом кран на баллоне (рис. 1) в процессе накачки воздуха должен быть закрыт.
После окончания процесса накачки воздуха в баллон водяной столбик в манометре не сразу займет окончательное положение, так как при быстром сжатии температура газа повышается.
После отключения насоса и перекрытия крана водяной столбик в манометре не сразу займет окончательное положение, так как при быстром сжатии температура газа повышается. Благодаря теплопроводности стенок сосуда через некоторое время температура воздуха в баллоне сравняется с температурой воздуха окружающей среды. Это состояние газа характеризуется температурой Т1 = ТА и давлением р1 (на рис. 2 точка 1). Давление р1 равно сумме первоначального давления газа в баллоне рА и избыточного давления газа в баллоне Dр1:
р1 = рА + Dр1.
После того как давление газа в баллоне установилось, открываем кран и воздух адиабатически расширяется, выходя в атмосферу. В тот момент, когда давление воздуха в баллоне становится равным атмосферному (высота столбиков воды в обоих коленах манометра сравнивается), кран быстро закрывают. При расширении температура газа в баллоне понижается. Это состояние представлено точкой 2 на рис. 2. В первоначальный момент температура ниже ТА окружающей среды. Через некоторое время после закрытия крана температура воздуха в баллоне повышается до температуры ТА за счет теплообмена с окружающей средой, а давление в баллоне при этом повысится на величину избыточного давления Dр2.
Состояние газа будет характеризоваться температурой Т1 и давлением
р3 = рА + Dр2.
Это состояние представлено точкой 3 на рис. 2. Таким образом, процесс перехода газа из состояния 1 в состояние 2 происходит адиабатически, а из состояния 2 в состояние 3 изохорически. Точки 1 и 3 диаграммы лежат на одной изотерме. Адиабатическое расширение при переходе из состояния 1 в состояние 2 описывается уравнением Пуассона:
р1 (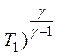 = р2 (
= р2 (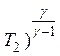 .
(4)
.
(4)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.