Реальным называется газ, в котором заметную роль играют силы межмолекулярного взаимодействия. Напомним, что в идеальном газе молекулы не взаимодействуют на расстоянии, а испытывают лишь упругие столкновения друг с другом и со стенками сосуда, в котором находится газ. Молекулы идеального газа имеют бесконечно малый объём; размерами же молекул реального газа пренебречь нельзя. На близком (сравнимом с размерами самих молекул) расстоянии друг от друга, молекулы реального газа отталкиваются, однако на больших расстояниях в газе могут оказаться существенными уже силы межмолекулярного притяжения.
 Процессы испарения и конденсации в замкнутом объёме удобно
пояснить, используя график изотермы реального газа в координатах p -
V. На рис. 1 представлены изотермы реального газа для четырёх температур
T, Т¢,
TК и T¢¢, причём Т < T¢ < TК < Т¢¢.
Процессы испарения и конденсации в замкнутом объёме удобно
пояснить, используя график изотермы реального газа в координатах p -
V. На рис. 1 представлены изотермы реального газа для четырёх температур
T, Т¢,
TК и T¢¢, причём Т < T¢ < TК < Т¢¢.
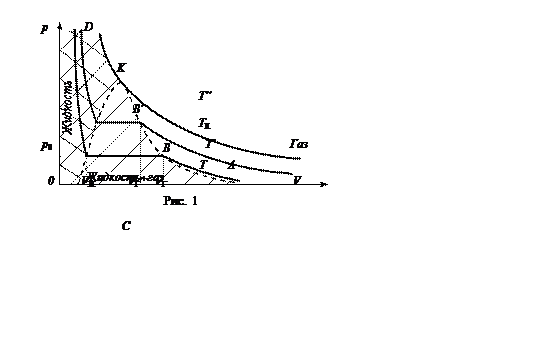 |
При температурах меньше ТК (которая называется критической) на соответствующих кривых можно выделить три участка. В области больших V вещество находится в газообразном состоянии (участок АВ), причём, чем больше V, тем график ближе к изотерме идеального газа. При сжатии газа его поведение всё больше и больше отличается от идеального; объём газа уменьшается до тех пор, пока не начнётся конденсация. Точки В и B¢соответствуют значениям объёма газа VГ, и V¢Г, при которых начинается образование жидкой фазы.
На участке ВС имеет место динамическое равновесие между испарением и конденсацией, в сосуде находятся как пар, так и жидкость, причём пар является насыщенным. Если такой пар сжимать, то из него в жидкую фазу уходит часть молекул. Тем не менее, их концентрация n в самом паре остаётся неизменной, а значит, остаётся постоянным и давление p0:
р0 = n k T, (4)
|
Если сжатие продолжать, то наступит момент, когда объём газовой фазы уменьшится до нуля и в сосуде останется лишь одна жидкость (этому моменту соответствует точка С на изотерме; объём жидкости при этом равен VЖ ). Участок CD на графике описывает сжатие самой жидкости, а поскольку для того, чтобы даже немного сжать жидкость, надо приложить очень большое давление, то он является практически вертикальным.
Заметим, что при повышении Т отрезок ВС уменьшается до тех пор, пока не выродится в точку (точка К на рис. 1), которой соответствует критическая температура ТК. Выше этой температуры различие в физических свойствах между жидкостью и её насыщенным паром исчезает, и вещество при любых давлениях находится лишь в газообразном состоянии.
Таким образом, до тех пор, пока водяные пары в воздухе далеки от насыщения, его можно считать идеальным газом. В то же время, если воздух уже содержит достаточное количество водяного пара, то, понижая температуру, можно достичь такого состояния, что пар станет насыщенным, а при дальнейшем охлаждении начнёт конденсироваться. Избыток влаги выделяется в виде мельчайших капель, образующихся на центрах конденсации: пылинках, частицах дыма, ионах других газов и т. д. Когда капли появляются в воздухе, мы говорим о тумане; капли на поверхности земли, на листьях и траве называются росой.
Чтобы представить себе, насколько меняется содержание Н2О в воздухе при уменьшении температуры, сделаем следующую оценку. Известно, что при +30°С плотность насыщенного водяного пара составляет 0,03кг/м3, а при 10°С - 0,01 кг/м3. Таким образом, из каждого кубометра воздуха при охлаждении его от +30°С до +10°С должно выделиться в виде капель тумана или росы 20 г воды.
Для количественной оценки влажности газов на практике используется ряд характеристик, причём (в силу исторических причин) в различных областях науки и техники находят преимущественное употребление те или иные из них. Эти характеристики (они называются гигрометрическими) можно разделить на следующие группы.
I. Характеристики концентрации водяного пара:
1) абсолютная влажность f - масса водяного пара, содержащегося в единичном объёме воздуха. Абсолютная влажность имеет тот же смысл, что и плотность водяного пара и измеряется в граммах на кубический метр: [f] = г/м3.
2) упругость (или парциальное давление) водяного пара pВ; обычно измеряется в миллиметрах ртутного столба: [pВ] = мм рт. ст. При данной температуре 0 < pВ < р0 , где р0 - максимальная упругость (давление насыщенного пара). Для пересыщенного пара возможно и рВ > р0.
II. Температура точки росы:
Температурой точки росы называется температура, до которой должен охладиться воздух с тем, чтобы находящийся в нём водяной пар достиг состояния насыщения (при данной влажности воздуха и неизменном давлении).
III. Характеристики влажностных отношений:
1) влагосодержание d - отношение массы водяного пара к массе сухого воздуха, содержащегося в том же объёме;
2) объёмное влагосодержание c0 или c- отношение объёма водяного пара к объёму воздуха (соответственно сухого или влажного)1;
3) молярная доля водяного пара s - отношение числа молей водяного пара к общему числу молей влажного воздуха.
4) Относительной влажностью воздуха jназывается отношение его абсолютной влажности f к максимально возможной F при данной температуре; j измеряется в процентах или в относительных единицах. Таким образом, относительная влажность вычисляется по формуле
j = (f / F) × 100 % . (5)
Иногда это выражение записывается в виде
j = (pВ / p0) × 100 % . (6)
Действительно, используя уравнение Клапейрона-Менделеева применительно к водяному пару, имеющему парциальное давление рВ, массу m и молярную массу m, получаем:
f = m / V =(m pВ) / (R T), (7)
F = m0 / V =(m p0) / (R T) (8)
(здесь m0 - масса насыщенного пара при той же температуре). Таким образом, оказывается, что
j = (f / F) × 100 % = (pВ / p0) × 100 % . (9)
|
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.