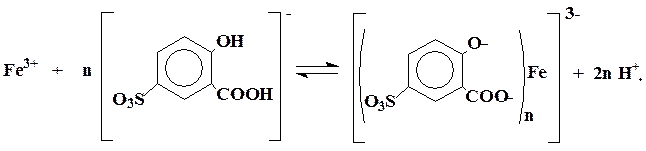
Состав образующихся комплексов будет зависеть от рН раствора, так как с изменением рН будет изменяться концентрация анионов (SO3Sal)3-. Каждый комплекс существует в определенном интервале рН и характеризуется своим спектром поглощения:
|
Значение рН |
Окраска |
|
|
n = 1 |
1,8–2,5 |
фиолетовая |
|
n = 2 |
4–8 |
красно-бурая |
|
n = 3 |
8–11,5 |
желтая |
При рН > 12 трисульфосалициловый комплекс железа разлагается с образованием осадка основных солей и гидроксида железа.
Таким образом, при фотоколориметрическом определении железа с сульфосалициловой кислотой необходимо придерживаться определенной кислотности раствора. В настоящей методике используется определение железа в виде трисульфосалицилата, имеющего максимум поглощения при 420 нм с молярным коэффициентом поглощения ε = 5,6 × 103.
Для построения калибровочного графика 10,00 мл запасного стандартного раствора железа помещают в мерную колбу на 100,0 мл, разбавляют водой до метки и перемешивают. Отбирают из этой колбы аликвоты 1, 2, 3, 4, 5 мл в мерные колбы на 50,00 мл. Растворы в мерных колбах разбавляют водой примерно до 25 мл, добавляют 5 мл раствора сульфосалициловой кислоты, 10 мл 10 % раствора аммиака, доводят водой до метки и перемешивают. Одновременно готовят «холостую пробу».
Из мерной колбы с анализируемым раствором отбирают аликвоты 3 и 4 мл в мерные колбы на 50 мл. Прибавляют 5 мл 15 % раствора HCl, через 10 мин разбавляют водой до 25 мл и далее поступают так же, как при приготовлении растворов для калибровочного графика.
Измерение оптической плотности окрашенных растворов проводят на фотоэлектроколориметре с соответствующим светофильтром в стеклянных кюветах (l = 1 см) относительно «холостой пробы». Строят график зависимости оптической плотности стандартных растворов от концентрации: А = f(CFe). По калибровочной прямой, построенной по методу наименьших квадратов, определяют концентрацию исследуемого раствора и рассчитывают содержание железа (в мг).
4. Комлексонометрическое определение меди. Определение меди основано на реакции комплексообразования с ЭДТА, в качестве металлиндикатора используется мурексид (аммонийная соль пурпуровой кислоты). Комплекс мурексида с медью при рН 7–8 окрашен в желтый цвет, при титровании образуется более прочный комплекс меди с ЭДТА (lg β = 18,8; 20°C, ионная сила 0,1). Точка эквивалентности фиксируется по появлению красно-фиолетовой окраски свободного мурексида.
Из мерной колбы с исследуемым раствором отбирают аликвоту 25,00 мл в коническую колбу, нейтрализуют раствором NaOH по каплям до появления бледно-голубой окраски раствора (при перемешивании), затем по каплям добавляют 5 % раствор HCl до исчезновения окраски, что соответствует приблизительно значению рН раствора 5 (можно проконтролировать по универсальной индикаторной бумаге). Далее добавляют 20–30 мг мурексида (примерно 1/3 шпателя) и устанавливают окончательное значение рН 7–8 прибавлением 3 % раствора аммиака до чисто желтой окраски. Для правильного фиксирования точки эквивалентности готовят раствор «свидетеля».
Титрование раствором ЭДТА проводят не менее 5–6 раз, по каждому изпараллельных определений рассчитывают содержание меди (в мг), находят среднее значение и доверительный интервал для заданной вероятности 0,95.
Работу со следующей аликвотой необходимо проводить только после окончания титрования предыдущей.
Задания и вопросы
1. Дайте полную характеристику строения и свойств смолы КУ-2.
2. Как определить обменную емкость смолы КУ-2?
3. Напишите все уравнения реакций, которые протекают в ионообменной колонке при ее подготовке, хроматографировании анализируемого раствора и элюровании компонентов. Почему смола для разделения используется в NH4+ – форме?
4. Можно ли было разделить анализируемые компоненты, пропуская их в виде аква-ионов через колонку с КУ-2?
5. Что Вы можете сказать о селективности смолы КУ-2? Как получить ее количественную характеристику?
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.