4. Определение хлорид-иона. В другой аликвотной части раствора определяют содержание хлорид-иона меркуриметрическим методом, который основан на реакции образования малодиссоциированного соединения:
![]()
![]()
Конец титрования фиксируется по появлению сиреневой окраски за счет образования соединения ртути с дифенилкарбазоном.
По концентрации водородных ионов, известной из результатов предыдущего титрования, рассчитывают pH раствора и, если среда более кислая (рН < 1,5), аликвоту разбавляют рассчитанным количеством воды для достижения оптимальной области рН. Затем к раствору добавляют 2–3 капли дифенилкарбазона и титруют раствором Hg(NO3)2 до появления бледно-сиреневой окраски. рассчитывают содержание хлорид-иона по среднему из 3–4 результатов титрования, а содержание сульфат-иона (мэкв) определяют по разности.
5. Расчет погрешности определения содержания хлорид- и сульфат-ионов. Вследствие того, что количество хлорид-ионов определяется прямым титрованием, а сульфат-ионов – косвенным методом – по разности, погрешность в определении SO42- будет всегда превышать погрешность определения Cl-, так как включение дополнительной операции в процесс определения в любом случае уменьшает его точность. По закону распространения ошибок:
![]() ,
,
где σ – абсолютная погрешность определения. Относительная погрешность определения хлорид-иона может быть рассчитана с учетом погрешности всех величин, входящих в расчетную формулу:
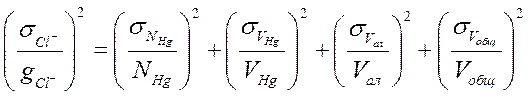
и аналогичным образом для суммарного содержания Cl- и SO42-.
Задания и вопросы
1. Рассчитайте по результатам титрования среднее содержание Cl- и SO42-(ммоль экв.) в анализируемой пробе.
2.
Руководствуясь п. 5, рассчитайте и
сравните погрешности определения компонентов пробы, приняв, что ![]() ,
, ![]() ,
,
![]() .
.
Какая стадия измерения вносит максимальный вклад в суммарную погрешность?
3. Дайте полную характеристику смоле КУ-2, приведите основные характеристики для нее или смолы подобного типа.
4. Напишите уравнения всех реакций, протекающих на стадии подготовки колонки и при последующем хроматографировании.
5. Происходило ли в колонке ионообменное разделение?
6. Составьте схему эксперимента для определения суммы катионов при совместном присутствии их в растворе, используя подход, аналогичный описанному выше.
7. Рассчитайте, какое минимальное количество смолы определенного типа необходимо для выполнения анализа Вашей пробы.
ИОХ 2. Ионообменное разделение железа и меди и их количественное определение
Приборы, реактивы, посуда
1. Хроматографическая колонка с катионитом КУ-2 в NH4+ -форме.
2. Фотоэлектроколориметр, кюветы (L = 1 см).
3. Соляная кислота, 10 % и 15 % раствор.
4. Аммиак, 3 % и 10 % раствор.
5. Гидроксид натрия, 5 % раствор.
6. Лимонная кислота, 20 % раствор.
7. Сульфосалициловая кислота, 20 % раствор.
8. Запасный стандартный раствор железа, 1 мг/мл; рабочий стандартный раствор железа, 0,1 мг/мл.
9. Стандартный раствор ЭДТА (~0,01 М).
10. Ферроцианид калия, K4[Fe(CN)6], 10 % раствор.
11. Роданид аммония, NН4NCS, 10 % раствор.
12. Индикаторы: универсальная индикаторная бумага, мурексид (смесь с NaCl – 1:100).
13. Стаканы для анализируемого раствора и растворов элюентов.
14. Мерные колбы на 200,0, 100,0 и 50,00 мл.
15. Конические колбы для титрования.
16. Пипетка Мора на 25,00 мл, пипетка с делениями, мерные цилиндры.
17. Пробирки для качественных реакций.
Сущность работы
Количественное определение железа и меди при совместном присутствии их в растворе обычно требует предварительного их разделения. Такая проблема, например, возникает при анализе медно-железных керамических сплавов, причем при осаждении железа аммиаком в виде гидроксида наблюдается значительная адсорбция меди из раствора, так что для полного разделения железа и меди необходимо трех- четырехкратное переосаждение. Применение ионообменной хроматографии значительно упрощает задачу разделения этих элементов. Разделение железа и меди на ионообменной смоле КУ-2 основано на переведении катионов этих элементов в комплексные ионы противоположных знаков: железа – в анионный, меди – в катионный.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.