“+” простота аппаратуры, отсутствие необходимости калибровки прибора
“-” область измерения в интервале рН от 1 до 8, нельзя определять рН в р-рах, в кот.присутствуют окислители или восстановители
3) при помощи стеклянного электрода
Сосуд из тонкого стекла с повышенной электрической проводимостью, наполненный р-ром, в кот.погружен электрод 1-го или 2-го рода.
Eст = E0ст -2,303b0pH
где E0ст - потенциал стеклянного электрода
Составляют электрохимический элемент
(-) Hg, Hg2Cl2 | KCl aq || испытуемый р-р, Н+ | стеклянный электрод (+)
ЭДС этой цепи равна E = Eст – Eкал
![]()
37. Потенциометрическое титрование.
Метод потенциометрии основан на определении электродных потенциалов измерением ЭДС различных цепей. Существуют отдельные области применения потенциометрических определений:
Суть: титруемый р-р помещается в отдельную емкость и в него электрод.Р-р титруется основанием или кислотой и опр-ся изм-ие потенциала эл-да и рН.
 7. Реальные
растворы, отклонения от Рауля.
7. Реальные
растворы, отклонения от Рауля.
«+» и «-» отклонения обусловлены разными факторами.
Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, т.е. FA-B < FA-A, то это облегчит переход из жидкой фазы в паровую (по сравнению с чистыми жидкостями) и будут «+» отклонения.
Усиление взаимного притяжения в разнородных молекулах (сольватация, водородная связь, образование химического соединения) затрудняетпереход в газовую фазу и будут отрицательные отклонения.
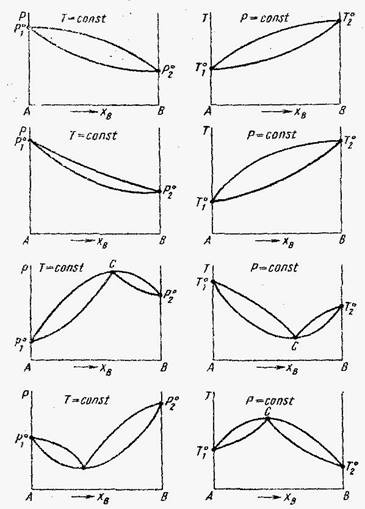
I – Растворы с незначительными положительными отклонениями.
II – Растворы с незначительными отрицательными отклонениями.
III – Растворы со значительными положительными отклонениями.
IV – Растворы со значительными отрицательными отклонениями.
Растворы со значительными положительными или отрицательными отклонениями от идеальности способны образовывать азеотропные смеси, которые на диаграммах состояния изображены точкой с. Азеотропные смеси – это растворы при испарении которых получается пар того же состава, что и исходная жидкая смесь. В реальных растворах азеотропная смесь имеет самую низкую или самую высокую температуру кипения.При изменении внешнего давления изменяется нетолько Ткип,но и состав азеотропного раствора, т.е. азеотропная смесь не является хим. соединением. Азеотропные смеси образуются не только в системах со значительными отклонениями от з-на Рауля,но и в системах с незначительными отклонениями,если компоненты раствора имеют близкие Ткип, т.е. почти одинаковые давления пара над чистыми компонентами. В этом случае на диаграмме состояния появляется экстремум, лежащий в средней части диаграммы.Чем больше различие между Р01 и Р02 тем больше положение экстремума сдвинутов сторону одного из компонентов:при максимуме – в сторону более летучего;при минимуме – в сторону менее летучего.
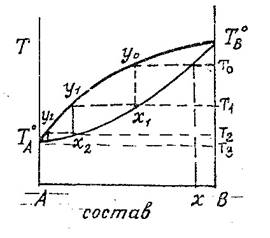
11. Методы разделения жидких смесей, ректификация.
14. Закон распределения Шилова-Нернста.Экстракция.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.