МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ
РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра органической химии
Курсовая работа.
«Алкилирование резорцина кариофилленом в организованной
среде и последующее его йодирование»
Выполнила: студентка 543 группы
Руководители: к.х.н. Фоменко В.В., Трошков В.В.
Преподаватель:
Работа выполнена в Лаборатории природных и биологически активных
соединений НИОХ СО РАН
Новосибирск,
2007
Содержание.
1. Введение -32. Литературный обзор -43. Общая часть -134. Экспериментальная часть -15-
5. Выводы
6. Приложения
7. Список использованной литературы
8. Отзыв о работе
1. Введение.
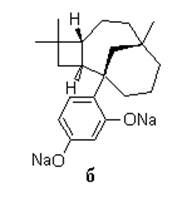
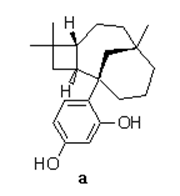
В данной работе осуществлена наработка резорциновой производной кариофиллена (РПК) (а) для проведения широкого ряда биологических испытаний. В ранее проведённых исследованиях Na соли данного соединения (б) было показано, что оно усиливает действие транквилизаторов, само по себе не влияя на ЦНС. Благодаря низкой токсичности упомянутое производное кариофиллена, является перспективным средством как для пролонгирования действия антианксиолитиков, так и уменьшения содержания токсичного транквилизатора в готовой лекарственной форме.
 |
 |
2. Литературный обзор.
Йодирование негетероциклических!!! ароматических соединений.
Йодпроизводные ароматических соединений могут изпользоваться в качестве строительных блоков для получения металлоорганических соединений, многие из йодаренов являются потенциальными интермедиатами в синтезе фармацевтических и биологически активных молекул. Кроме того, ввиду того, что атом йода более подвижен в реакциях замещения, чем атомы хлора или брома, они весьма полезны в катализируемых переходными металлами реакциях кросс-сочетания (реакции Сузуки, Хека, Штилле и Негиши), используемых в формировании углерод-угдеродных, углерод-азотных и других одинарных связей.
Но, к сожалению, синтез таких полезных арилиодидов представляет собой более сложную задачу по сравнению с синтезом других арилгалогенидов. Но об этом позже.
Методы получения йодаренов можно разделить на несколько основных групп по механизму реакции. Это – реакции, протекающие по механизму электрофильного замещения, реакции с замещением атома галоида в хлор- и бромсодержащих органических соединениях и реакции, основанные на методе Зандмейера.
В настоящее время наиболее часто используются реакции электрофильного замещения, протекающие по бимолекулярному механизму SЕАr (ароматическое электрофильное замещение).
Схема!!!!
Первая стадия заключается в образовании π-комплекса, в котором электрофильная частица связывается с ароматическим кольцом за счёт всех его шести π-электронов. Процесс протекает легко, т.к. не требует значительной реорганизации устойчивой ароматической системы. Далее следуют две основные стадии. На первой из них образуется σ-комплекс. Это карбокатион (ареониевый ион), в котором между электрофилом и атомом углерода ароматического кольца имеется σ-связь. Σ-комплекс не обладает ароматичностью, однако его четыре π-электрона делокализованы в поле пяти sp2-гибидизованных атомов углерода. Шестой атом углерода, у которого замещается атом водорода, переходит в состояние sp3-гибидизации. Поэтому можно считать, что σ-комплекс резонансно-стабилизирован:
! Схема!!!!!
Далее, на следующей стадии, при отрыве протона от σ-комплекса восстанавливается ароматическая структура с образованием продукта реакции электрофильного ароматического замещения. Во многих реакциях отрыву протона на заключительной стадии способствует соответствующее основание.
Как следует из представленной схемы, электрофильное ароматическое замещение протекает по механизму присоединения–отщепления. За присоединением электрофильного агента к ароматическому субстрату с образованием σ-комплекса следует отщепление протона с образованием продукта реакции.
Реакции электрофильного ароматического замещения, как правило, следуют кинетическому уравнению второго порядка: w = k[ArН][Е+]. Лимитирующей стадией процесса может быть образование σ-комплекса, если скорость его распада на конечные продукты велика по сравнению со скоростью обратной реакции (k3 > k2). Такое соотношение наблюдается наиболее часто. Если же k2 > k3, то лимитирует стадия распада σ-комплекса. Примером таких реакций является сульфирование. [1-2]
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.